Амилоид — не всегда плохо?
Слово «амилоид» традиционно ассоциируется с чем-то аномальным, например, с «бляшками» в мозге у пациентов c болезнью Альцгеймера или прионовыми инфекциями. До сих пор в большинстве справочников «амилоид» рассматривают исключительно как патологию, результат нарушений укладки белка, возникающий при более чем 50 заболеваниях (амилоидозах). Однако на сегодня установлено, что амилоид — это не всегда плохо, это просто специфическая белковая архитектура, которая может возникать как аномалия, а может быть нормой. В последнем случае говорят о «функциональных амилоидах»
Термин «амилоид» возник в связи с тем, что немецкий врач и ученый Рудольф Вирхов еще в середине XIX в. из-за характерной реакции с йодом ошибочно определил как крахмал вещество, которое откладывается в органах пациентов с «сальной болезнью» при туберкулезе, сифилисе, лепре. Через некоторое время выяснилось, что амилоидные бляшки состоят преимущественно из белков, но название сохранилось.
Сегодня термин «амилоид» имеет несколько определений. Одно из них, классическое гистопатологическое, гласит, что это аномальные внеклеточные белковые (белково-полисахаридные) отложения, состоящие из параллельно расположенных фибрилл, для которых характерна определенная вторичная структура — кросс-бета-складчатая.
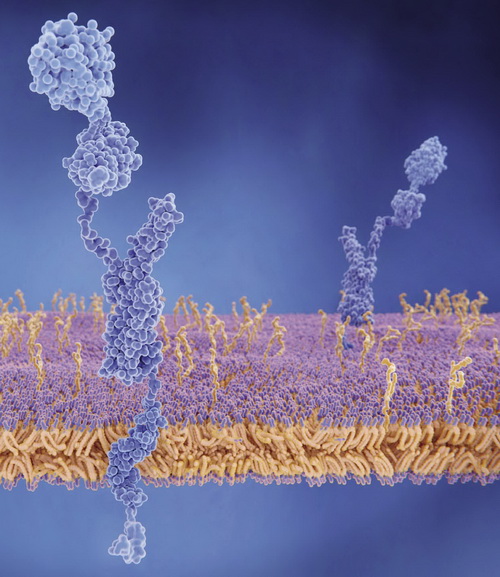
Формирование бета-амилоида на клеточной мембране
Другое, более современное, определение описывает амилоиды шире и включает любые, как патологические, так и нормальные белковые фибриллы, которые состоят из пептидных мономеров и формируют кросс-бета-складчатую структуру [1].
Амилоид обладает способностью привлекать и присоединять к своим концам аналогичные молекулы (мономеры), за счет чего растет. Бета-тяжи в фибриллах амилоида располагаются перпендикулярно к оси полимера. В стабилизации структуры амилоидных фибрилл участвуют водородные связи, а также нековалентные взаимодействия между боковыми группами аминокислотных остатков соседних полипептидов. Обилие таких связей объясняет высокую устойчивость амилоидов к изменениям окружающей среды (ее гидрофобности, концентрации соли, pH, температуры, давления, влиянию денатурирующих агентов и протеаз).
Если патологические амилоиды возникают в результате нарушения пространственной укладки какого-то белка, то функциональные амилоиды не сопряжены с какими-либо нарушениями, а выполняют разнообразные полезные функции внутри и снаружи про- и эукариотических клеток.
Среди нормальных функций амилоидов в клетках — защита и поддержание формы клетки, запасание и высвобождение пептидов, эпигенетическая наследственность, сигнальная трансдукция, долговременная память.
Об амилоидной природе белковых фибрилл судят по окрашиванию специфическими красителями, а также по наличию кросс-бета-складчатой структуры, которую выявляют с помощью спектроскопии кругового (циркулярного) дихроизма — метода, основанного на оптической анизотропии, проявляющейся в различии коэффициентов поглощения света, поляризованного по правому и левому кругу.
Функциональные амилоиды бактерий и дрожжей [2]
Амилоидные фибриллы часто являются компонентами внеклеточного матрикса как у грамположительных, так и у грамотрицательных бактерий. Примером являются белки карлины (curli, от англ. curl — завиток), выделяемые Escherichia coli, Salmonella и некоторыми другими представителями энтеробактерий.
Карлины — это амилоидные фибриллярные структуры, одним концом закрепленные на внешней мембране бактерий. Карлины E. coli связываются со многими белками человека, в частности фибронектином, ламинином, коллагеном I типа, молекулами главного комплекса гистосовместимости I класса, плазминогеном, облегчая микроорганизму последующее внедрение в организм хозяина. Карлины необходимы для формирования бактериальных биопленок и являются основным белковым компонентом внеклеточного матрикса. Они активно экспрессируются при температуре ниже 30°C, низкой концентрации питательных веществ и на стационарной стадии роста, то есть в условиях, в которые энтеробактерии попадают вне организма хозяина и в которых формирование биопленок может способствовать их выживанию. Кроме того, карлины помогают присоединению бактерий к различным поверхностям, включая клетки растений, нержавеющую сталь, стекло и пластик.
Если патологические амилоиды возникают в результате нарушения пространственной укладки какого-то белка, то функциональные амилоиды не сопряжены с какими-либо нарушениями, а выполняют разнообразные полезные функции внутри и снаружи про- и эукариотических клеток
Амилоидные нити (пили) на поверхности Mycobacterium tuberculosis играют важную роль в патогенезе туберкулеза. Они способны связываться с ламинином — гликопротеином внеклеточного матрикса в организме человека, способствуя тем самым прочному закреплению бактерии в тканях-мишенях. Микобактерии, лишенные гена, кодирующего белок пилей, проявляют пониженную вирулентность. У пациентов с туберкулезом обнаруживают высокий титр антител, взаимодействующих с пилями M. tuberculosis.
В составе биопленок, образуемых Staphylococcus aureus, были идентифицированы внеклеточные амилоидные фибриллы, состоящие из коротких пептидов, называемых фенол-растворимыми модулинами (PSMs). Они необходимы S. aureus для обеспечения устойчивости биопленок к различным диспергирующим агентам и механическим воздействиям. Предполагается, что поиск ингибиторов полимеризации амилоидов и, соответственно, формирования биопленок поможет в разработке средств лечения стафилококковых инфекций.
Дрожжеподобный грибок Candida albicans — возбудитель кандидоза — также формирует биопленки. В их состав входят так называемые Als-адгезины, некоторые из них образуют амилоидные фибриллы и обеспечивают взаимодействие клеток C. albicans с белками внеклеточного матрикса млекопитающих, между собой, с клетками других видов дрожжей и бактериями.
Еще одним примером функциональных амилоидов могут служить гидрофобины — большое семейство секретируемых низкомолекулярных белков у грибов, в том числе патогенных. Особенностью гидрофобинов, отраженная в названии, является обилие в их составе гидрофобных аминокислот. Эти амилоиды участвуют в формировании спор и плодового тела, а также важны для прикрепления к поверхности клеток организма хозяина и защиты от его иммунной системы. Например, при инфекции дерматофита Arthroderma benhamiae гидрофобин HypA маскирует гриб от иммунной системы хозяина, тогда как делеция гена данного гидрофобина приводит к быстрому смачиванию мицелия гриба, что вызывает активный иммунный ответ на него.
Функциональные амилоиды эукариот
У эукариот (это истинно-ядерные организмы, клетки которых имеют оформленное клеточное ядро, отделенное от цитоплазмы ядерной оболочкой) непатогенные амилоиды часто связаны с образованием защитных поверхностных структур. Примером может служить хорион (оболочка яйца) у бабочки Antherae apolyphemus, в состав которого входит около 200 небольших белков, способных образовывать амилоидные фибриллы. У пауков (Araneae) в составе паутины обнаружены белки спидроины, которые формируют фибриллы, свойства которых сходны с таковыми амилоида.
У млекопитающих также обнаружены функциональные амилоиды. Так, амилоидный белок Mα участвует в синтезе пигментов меланинов, защищающих клетки от ультрафиолетового излучения и окислительного повреждения. Меланосомы — органеллы клеток человека, в которых образуются меланины, — содержат трансмембранный белок Pmel17, из которого в результате протеолитического расщепления образуется белок Мα. Последний формирует фибриллы, которые ускоряют полимеризацию меланинов, играя роль матрицы в ходе синтеза.
Важный пример функционального амилоида относится к механизмам памяти [3]. Как известно, у человека и животных имеется два вида памяти: кратковременная и долговременная. Кратковременная память опосредуется фосфорилированием некоторых уже существующих белков и укреплением имеющихся синаптических связей. Но далее это состояние нужно зафиксировать, и фиксация его происходит через переход в амилоидное состояние белка, который получил название Orb2 у дрозофилы и CPEB — у моллюска Aplysia. Эти белки являются регуляторами экспрессии других белков на уровне трансляции, и их переход в амилоидное состояние изменяет экспрессию некоторого круга белков и таким образом придает измененные свойства всему аксону. Есть основания полагать, что у человека в механизмах формирования долговременной памяти также задействован амилоидный белок.
В 2014 г. амилоидные структуры были обнаружены в инфламмасоме — особом белковом комплекс в макрофагах и нейтрофилах, который играет важную роль в системе врожденного иммунитета — запускает воспалительные реакции при контакте клетки с микроорганизмами [4]. Сборка инфламмасома происходит на основе белка ASC, который способен образовывать амилоид. В инфламмасому вовлекаются и другие белки, которые формируют амилоидные фибриллы и одновременно содержат функциональные домены, в частности, предшественник протеолитического фермента каспазы-1, отвечающего за инициацию воспалительного ответа. Таким образом, в ответ на чужеродный антиген происходит амилоидная сборка инфламмасомы с многочисленными доменами каспазы, их близость друг к другу затем индуцирует аутопротеолитическое созревание прокаспазы-1 в активную каспазу-1, которая, в свою очередь, обеспечивает активацию цитокинов и индукцию пироптоза (запрограммированной литической смерти клетки).
У истоков жизни
Ученые описывают все новые функциональные амилоиды, и их важная роль в жизнедеятельности самых разных организмов уже не вызывает сомнений. Амилоиды широко распространены, они более стабильны и устойчивы к изменениям среды, чем образующие их пептиды, способны сами себя собирать и сами себя воспроизводить, не нуждаясь при этом ни в нуклеиновых кислотах, ни в мембранах. В связи с этим высказана гипотеза о том, что амилоид — это некая переходная форма от неживой к живой природе [5]. Эту роль традиционно отводят РНК, которая может выступать и как фермент, и как носитель генетической информации. Однако амилоидные системы подходят на роль «пребиотиков» ничуть не хуже.
Регулярная структура амилоида позволяет ему взаимодействовать с другими полимерами и регулярными структурами, включая липидные мембраны. Эти взаимодействия могут вызывать кооперативные эффекты, расширяя функциональные возможности амилоидов. Новые функции, возможно, являясь синергичными, стабилизировали связи между отдельно эволюционирующими химическими системами. Так могли появиться системы, где функции были разделены — за хранение информации начали отвечать нуклеиновые кислоты, а за катализ — преимущественно белки.
Татьяна Ткаченко, канд. биол. наук
Список литературы находится в редакции
“Фармацевт Практик” #11′ 2018