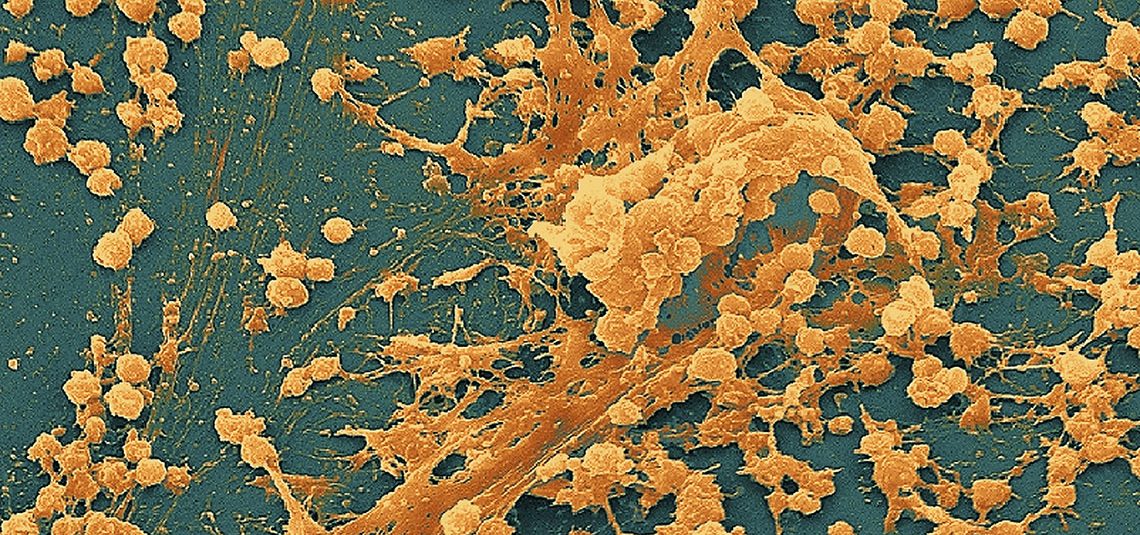
Биопленки — еще одна причина неэффективности антибиотиков
Трудности в лечении инфекционной патологии связаны не только с антибиотикорезистентностью. Часто бактерии, демонстрирующие в лабораторных условиях высокую чувствительность к тому или иному лекарственному препарату, в условиях in vivo абсолютно игнорируют его. Это может быть связано с тем, что возбудитель формирует биопленки
Биопленки — это сообщества бактерий одного или нескольких видов, для которых характерно сложное социальное поведение. Бактерии получают сигналы из окружающей среды, обмениваются сигналами между собой и при достижении определенной критической плотности значительно изменяют свой метаболизм, тем самым повышая шансы на выживание.
Биопленка состоит из бактерий, прикрепленных к субстрату и погруженных во внеклеточный полимерный матрикс. В качестве субстрата могут выступать как неживые объекты (пластик, металл, камень и т.д.), так и ткани живых организмов (слизистые оболочки, кожа, зубная эмаль и т.д.). Матрикс выделяет бактерии, который состоит из липополисахаридов, гликопротеидов, протеогликанов, нуклеиновых кислот и др. Явление межклеточного общения бактерий получило название «чувство кворума» (quorum sensing — QS). Сигнальные молекулы «чувства кворума» определяют экспрессию нескольких сот генов, в том числе отвечающих за продукцию вирулентных факторов и элементов биопленочного матрикса.
Читайте также: Смогут ли антимикробные пептиды заменить антибиотики?
В зависимости от того, какой микроб и где формирует биопленки, они могут быть полезными или опасными для человека. Так, биопленки, формируемые на слизистой оболочке кишечника симбионтной микрофлорой человека, являются важным фактором защиты пищеварительного тракта. В то же время биопленки играют ведущую роль в патогенезе многих заболеваний.
Высокую склонность к формированию биопленок проявляют основные возбудители госпитальных инфекций — Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa, Klebsiella pneumoniae. Установлена важная роль биопленок в развитии остеомиелита, среднего отита, пародонтита, кариеса и хронических легочных инфекций. Доказано участие биопленок в контаминации изделий медицинского назначения: катетеров (сердечных, внутривенных, мочевыводящих), искусственных клапанов сердца, суставов, контактных линз и т.д.
Клинической проблемой является то, что бактерии в составе биопленок значительно менее чувствительны к антибиотикам и дезинфицирующим средствам, а также факторам иммунной защиты организма-хозяина, чем те же бактерии в свободной форме. Это связано с плохой проницаемостью матрикса, воздействием химических факторов (повышенная кислотность, низкая концентрация кислорода в глубинных слоях биопленок и др.), а также относительно низким уровнем обмена веществ в сообществе.
Интересным феноменом, наблюдаемом в биопленках, является формирование под воздействием антибиотиков популяции микробных клеток, способных к персистенции. В этих клетках все процессы резко замедляются или вовсе замирают, поэтому бактерии становятся нечувствительными к антибиотикам. Из-за этих неуязвимых персиститующих клеток биопленки могут быть резервуарами хронической инфекции.
80% Мировой микробной биомассы находится в биопленках,а 75% бактериальных инфекций человека связаны с формированием и персистенцией биопленок
Терапевтическое воздействие на биопленки может быть направлено на механизмы первоначальной адгезии бактерий к поверхности, блокирование синтеза или разрушение полимерного матрикса, нарушение обмена информацией между клетками — «чувства кворума». При этом антибиопленочные средства не обязательно должны обладать бактерицидной активностью, так как их можно применять в комплексе с антимикробными препаратами. Рассмотрим некоторые подходы к решению проблемы биопленок в медицине.
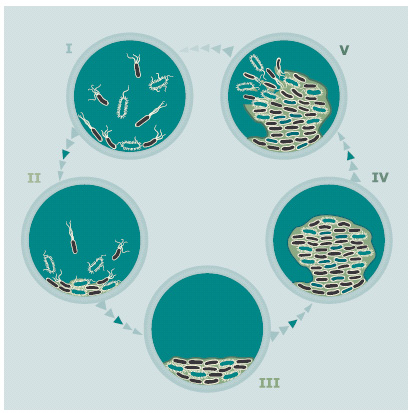
Формирование биопленки
Пробиотики — это борьба с бактериями их же оружием. Когда микроорганизмы формируют биопленку, они должны уметь не только расти, плодиться и защищаться от неблагоприятных воздействий, но также конкурировать с другими бактериями, подавлять их рост, а также препятствовать формированию ими собственных биопленок. То есть лучшим источником антибиопленочных средств являются сами бактерии. Поэтому самым простым вариантом профилактики формирования биопленок является применение пробиотиков. Так, доказана антибиопленочная активность бактерий рода Lactobacilli при лечении инфекционных процессов в полости рта, влагалище, ранах [1].
Нарушение «чувства кворума» в биопленке помогает повысить чувствительность бактерий к антибиотикам. Добиться этого можно, препятствуя распространению сигналов между бактериальными клетками с помощью так называемых QS-ингибиторов. В роли последних могут выступать самые разные вещества, как природные, так и синтетические, а также ферменты и низкомолекулярные соединения. Например, в настоящее время проходит испытание метод, основанный на разрушении циклического дигуанозинмонофосфата (c-di-GMP) олигорибонуклеазой из Pseudomonas aeruginosa. C-di-GMP — вторичный посредник, характерный для микробных клеток. Вторичные посредники передают сигналы из среды внутрь бактериальной клетки, активируя в ней те или иные гены и запуская необходимые для выживания процессы. Разрушение c-di-GMP соответственно препятствует такой передаче сигналов и адаптации бактерий к меняющимся условиям среды, в том числе путем образования биопленок [2].
Читайте также: Где не работают антибиотики, помогут хищные бактерии?
N-ацетилцистеин — лекарственное средство, применяемое в клинической практике в качестве муколитика, оказалось эффективным антибиопленочным средством. В опытах in vitro N-ацетилцистеин подавлял способность к формированию биопленок, а также разрушал уже сформированные биопленки E. coli и S. epidermidis. В клинических тестах N-ацетилцистеин применяли в комбинации с антибиотиком у пациентов с рецидивирующими инфекциями верхних дыхательных путей, сопровождающимися формированием биопленок. Препарат в первый день вводили внутримышечно, затем — ингаляционно в течение 10 дней. Предполагают, что механизм активности N-ацетилцистеина против биопленок связан с нарушением адгезии бактерий на поверхности, разрушением внеклеточных полисахаридов биопленок и торможением их синтеза бактериями [3].
Различные ферменты, гидролизующие компоненты матрикса, могут быть использованы для разрушения уже сформированных биопленок. Установлено, что различные протеазы ферментов (папаин, трипсин и др.) частично угнетают образование микробных биопленок и усиливают действие на них различных антибиотиков. Хорошо изучен матрикс-деградирующий фермент дисперсин В — гликозидгидролаза, продуцируемый оральным патогеном Aggregatibacter actinomycetemcomitans. Дисперсин В разрушает один из главных матриксных полисахаридов — поли-N-ацетилглюкозамин (который, к сожалению, есть не во всех биопленках). Мукоидный матрикс P. auruginosa можно разрушить cобственным ферментом бактерии — альгинатлиазой, которая обеспечивает выход из биопленки свободных бактерий и делает их более чувствительными к антибиотикам [4].
Бактериофаги — вирусы бактерий, которые миллиарды лет эволюционируют вместе со своими хозяевами, не давая им ускользнуть. Не удивительно, что в арсенале бактериофагов есть средства, позволяющие поражать бактерии в биопленках, в частности, специальные ферменты деполимеразы, разрушающие полимерный матрикс, в который погружены бактерии. Кроме того, бактериофаги могут справляться с биопленками, лизируя бактерии-мишени постепенно — слой за слоем.
Лизины бактериофагов — ферменты, которые в ходе фаговой инфекции разрушают клеточную стенку бактерий (петидогликан гидролазы). Лизины, как и фаги, из которых их выделили, специфичны — действуют только на определенные виды (редко — несколько видов) бактерий. Важно, что лизины разрушают и свободные бактерии, и бактерии в биопленках. Так, например, лизин CF-301, выделенный из бактериофага, лизирующего Streptococcus suis, также разрушает различные виды стафилококков. Лизин CF-301 продемонстрировал способность лизировать биопленки, образованные метициллино-устойчивым золотистым стафилококком (MRSA), а также смешанные биопленки S. aureus и Staphylococcus epidermidis на полистироле, стекле, катетерах, сетчатых имплантах [5].
Нанотехнологии могут быть использованы для предотвращения формирования биопленок на твердых поверхностях, в частности, катетерах, имплантах и т.д. Наиболее перспективный метод предусматривает химическую модификацию поверхности с нанесением на нее наночастиц железа, серебра, цинка и титана. Многие наночастицы металлов характеризуются бактерицидными свойствами. При этом они легко могут проникать вглубь биопленок, уничтожая бактерии и там.
Низкотемпературную (холодную) плазму испытывают как средство разрушения биопленок в лабораторных культурах, на поверхностях продуктов питания, изделий медицинского назначения, зубов и даже в кожных ранах, инфицированных P. aeruginosa и S. aureus. Холодная плазма не токсична для живых тканей и не грозит образованием долгоживущих токсичных продуктов. Сложность представляет уничтожение бактерий холодной плазмой при большой толщине биопленки, а также в глубоких слоях ран [1].
Приведенные примеры не исчерпывают всех методов борьбы с биопленками, находящихся в разработке. Однако необходимо признать, что препараты, которые могли бы специфически и полностью подавлять образование биопленок и эффективно уничтожать бактерии внутри них, пока не зарегистрированы.
Читайте также: 10 перспективных альтернатив антибиотикам
Татьяна Ткаченко, канд. биол. наук
Литература
- Miquel S, Lagrafeuille R, Souweine B, Forestier C (2016) Anti-biofilm Activity as a Health Issue // Front. Microbiol, 7:592.
- Orra MW, Donaldsona GP, Severind GB, Wange J et al. (2015) Oligoribonuclease is the primary degradative enzyme for pGpG in Pseudomonas aeruginosa that is required for cyclic-di-GMP turnover // PNAS, 112: 36, E5048–E5057.
- Dinicola S, De Grazia S, Carlomagno G, Pintucci JP (2014) N-acetylcysteine as powerful molecule to destroy bacterial biofilms. A systematic review // Eur Rev Med Pharmacol Sci, 18 (19):2942-8.
- Kaplan JB (2010) Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses // J. Dent. Res, 89 (3):205-218.
- Schuch R, Khan BK, Raz A, Rotolo JA et al. (2017) Bacteriophage Lysin CF-301: a Potent Anti-Staphylococcal Biofilm Agent // Antimicrob. Agents Chemother, Posted Online 1 May 2017.
“Фармацевт Практик” #7-8′ 2017