Как исследуют ионные каналы, или Необычные «помощники» фармакологов
Исследования ионных каналов, обеспечивающих работу сигнальных систем в клетке, необходимы, в частности, для создания новых эффективных лекарственных средств (ЛС). О некоторых оригинальных подходах, с помощью которых проводят такие исследования, рассказывает Анатолий Соловьев, д-р мед. наук, профессор, зав. отделом экспериментальной терапии и руководитель Межведомственной лаборатории доклинического изучения лекарственных средств ГУ «Институт фармакологии и токсикологии НАМН Украины»
— Анатолий Иванович, почему плазматическая мембрана с ее ионными каналами является столь важным объектом исследований для фармакологов?
— Действительно, это один из важнейших и сложнейших объектов исследования. Дело в том, что в плазматическую мембрану встроено множество белковых структур, в ней находятся рецепторы, воспринимающие внешние химические сигналы и обеспечивающие «общение» клетки с клетками-соседями как близкими, так и далекими. Мембрану также пронизывают активные и пассивные транспортные комплексы, с помощью которых клетка обменивается веществом со своим окружением. В частности, среди них имеются так называемые ионные каналы, поры, образуемые трансмембранными белками, через которые ионы пассивно диффундируют в направлении более низкой концентрации. Обычно эти поры пропускают лишь определенные ионы, такие как калий, натрий или кальций. О принципах работы ионных каналов мы рассказывали ранее («Фармацевт Практик», № 2, 2015 г.).
Некоторые из ионных каналов сопряжены с собственными рецепторами. Таким образом, в живых системах постоянно происходит сопряженный перенос вещества и информации через клеточные мембраны. Лекарственные и другие химические вещества могут в значительной степени влиять на эти процессы. Поэтому такие сведения чрезвычайно важны как для лечения заболеваний, связанных с нарушением работы ионных каналов, так и в целях создания новых эффективных лекарств, оказывающих минимальное побочное действие.
— Какие из сигнальных молекул наиболее известны?
— Например, липофильная сигнальная молекула азота монооксида (NO), которая проходит через клеточную мембрану и активирует внутриклеточный «рецептор» (растворимую гуанилатциклазу), что приводит, в частности, к расслаблению сосудов и увеличению кровотока. Это открыло возможности создания нового поколения препаратов для применения у пациентов с сердечно-сосудистыми заболеваниями. За открытие роли NO как сигнальной

Анатолий Соловьев
молекулы американские ученые Р. Ферчгот, Л. Игнарро и Ф. Мурад в 1998 г. были удостоены Нобелевской премии по физиологии и медицине. Кстати, данное открытие лежит и в основе создания знаменитого силденафила — препарата от импотенции.
Еще одним примером может служить инсулин — сигнальная молекула, которая, связываясь с трансмембранным рецептором, запускает цепь хорошо известных метаболических превращений глюкозы.
Классическим примером сигнальных молекул можно считать также молекулы ацетилхолина и гамма-аминомасляной кислоты (ГАМК) или глутамата, которые взаимодействуют с соответствующими рецепторами, связанными или же не связанными с ионным каналом. Так, ацетилхолин, связываясь с Н-холинорецепторами, играет роль медиатора в нервной системе, а при взаимодействии с М-холинорецепторами на эндотелии сосудов приводит к освобождению NO из эндотелиальных клеток и расслаблению подлежащих гладкомышечных клеток (ГМК) сосудов или же к сокращению гладких мышц. В том случае, когда медиатор действует прямо на ГМК (в случае повреждения эндотелиальной выстилки), снижается частота сердечных сокращений, повышается секреция ряда желез и т.п. ГАМК является основным тормозным медиатором в нервной системе позвоночных, а глутамат обеспечивает процессы регуляции синаптической пластичности, то есть играет важную роль в обучении и запоминании/хранении информации.
Читайте также: Новые парадигмы классической фармакотерапии
— Возникает ли иногда необходимость блокировать работу ионных каналов?
— Очень часто. Для этого используют анестетики, анальгетики, антиаритмики и множество фармакологических агентов других классов. Вспомним хотя бы применение блокаторов кальциевых каналов для лечения артериальной гипертензии или блокаторов калиевых каналов для лечения сердечных аритмий. С блокаторами натриевых потенциал-управляемых каналов на практике сталкивался каждый, кому доводилось бывать у стоматолога, ведь используемые для обезболивания местные анестетики являются блокаторами именно этих каналов. Местные анестетики широко используются при проведении многих хирургических вмешательств. Они препятствуют возникновению (генерации) и проведению по нервному волокну потенциалов действия, а значит, и передаче в ЦНС болевых сигналов. Некоторые из этих препаратов местного действия обладают резорбтивным эффектом и могут оказывать кардиодепрессивное действие или даже влиять на деятельность ЦНС. Поэтому в настоящее время продолжается поиск новых местных анестетиков с таким механизмом действия, при котором побочные эффекты их применения будут минимальными.
— Какие работы в этом направлении кажутся вам наиболее интересными?
— Весьма интересными, с моей точки зрения, являются фундаментальные исследования взаимодействия некоторых природных токсинов с натриевыми ионными каналами. Природа — лучший изобретатель. И во многих случаях те у кого нет острых зубов или когтей, «вооружены» способностью нейтрализовать врага с помощью нарушения у него деятельности нервной системы, т.е. специальным токсином, мишенью которого являются ионные каналы. Изучение такого взаимодействия дает результаты сразу в трех направлениях: углубление знаний о свойствах ионных каналов, об эффектах токсинов как потенциальных анестетиков и, наконец, о возможностях защиты организма человека от воздействия этих ядов.
Читайте также: Стволовые клетки: правда и вымыслы
— Не могли бы вы привести пример такого токсина?
— Например, тетродотоксин, содержащийся в рыбе фугу, был открыт еще в 1906 г. В 1963 г. была установлена его трехмерная структура, а в 1972 г. он был синтезирован группой японских исследователей.
На начальных этапах исследований этот яд применяли в клинике как мощное обезболивающее средство при лечении некоторых форм опухолевых заболеваний, однако, в дальнейшем, вследствие особой ядовитости, его вытеснили другие местные анестетики — блокаторы натриевых каналов, более безопасные для жизни и здоровья, в частности, новокаин. Ныне тетродотоксин, а также некоторые другие природные яды, широко применяемые биологами и фармакологами, являются необычными «помощниками» в проведении исследования мембран. Тетродотоксин 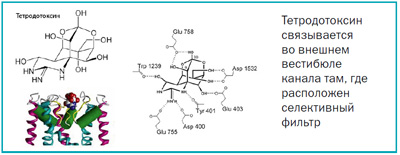 связывается во внешнем вестибюле канала там, где расположен селективный фильтр. Если использовать не вполне научную терминологию, то данное действие можно сравнить с затыканием бутылки пробкой. Причина необычайно высокой активности тетродотоксина кроется в том, что его сравнительно небольшая молекула имеет жесткий каркас, который «декорирован» большим количеством функционально активных групп. Поразительно, но по данным экспериментов, каждая из них имеет специфического «ответчика» в поре. При этом сама геометрия тетродотоксина практически идеально соответствует воронкообразной структуре внешнего вестибюля канала. Малейшие изменения в структуре токсина или канала нарушают химико-стерическую комплементарность и приводят к резкому снижению активности.
связывается во внешнем вестибюле канала там, где расположен селективный фильтр. Если использовать не вполне научную терминологию, то данное действие можно сравнить с затыканием бутылки пробкой. Причина необычайно высокой активности тетродотоксина кроется в том, что его сравнительно небольшая молекула имеет жесткий каркас, который «декорирован» большим количеством функционально активных групп. Поразительно, но по данным экспериментов, каждая из них имеет специфического «ответчика» в поре. При этом сама геометрия тетродотоксина практически идеально соответствует воронкообразной структуре внешнего вестибюля канала. Малейшие изменения в структуре токсина или канала нарушают химико-стерическую комплементарность и приводят к резкому снижению активности.
Другим примером использования токсинов в научных исследованиях ионных каналов могут служить конотоксины, синтезируемые хищными брюхоногими моллюсками рода Conus. Конотоксины — молекулы совершенно иного типа. Этот яд помогает конусам добывать пищу: они выбрасывают особый вырост ротового аппарата как гарпун с отравленным наконечником и поражают им других моллюсков или рыб. Он весьма опасен и для человека.
Конотоксины — пептиды, как правило, с несколькими цистеиновыми S–S-мостиками, которые обеспечивают более или менее жесткую укладку аминокислотной цепочки. И если тетродотоксин — это одна высокоспецифическая молекула, то конусы производят множество пептидных токсинов, принадлежащих к разным семействам и атакующих различные мишени. Те из них, которые воздействуют на потенциал-управляемые каналы, так называемые мю-конотоксины, также являются высокоспецифичными. Они тоже связываются во внешнем вестибюле натриевого канала. Но размеры у них совершенно другие — пептидный токсин внутрь узкой части канала пройти не может, поэтому он «садится» на канал сверху. В соответствии с приведенной выше аналогией это уже не пробка, а крышка.
Читайте также: Яд моллюсков против боли
Таких примеров существует множество, а тема взаимодействия токсинов с белками — неисчерпаема. Приведенные выше примеры показывают, что на сегодня исследования ионных каналов проводятся на самом высоком молекулярном уровне.
— Какие еще «необычные» помощники, кроме природных токсинов, используют для исследования ионных каналов, например, в вашей лаборатории?
— Как известно, взаимодействие лекарства с каналом осуществляется благодаря химической связи его молекулы либо с рецептором, сопряженным с данным каналом, либо непосредственно с субъединицами канального белка. Недавно нам удалось обнаружить принципиально новый механизм управления каналом. Оказалось, что наночастицы золота, благодаря наличию плазмонного облака на их поверхности, обладают способностью взаимодействовать с сенсором потенциал-управляемых каналов, что позволяет дистанционно (!) управлять их активностью. При этом напряженность электрического поля плазмона и соответственно степень влияния на канал можно модулировать с помощью лазера с необходимой длиной волны. Перспективы открываются захватывающие, однако это тема отдельного разговора.
Подготовил Руслан Примак,
канд. хим. наук

