КОВІД-ВАКЦИНИ: А ВСЕ-ТАКИ ВОНИ ПРАЦЮЮТЬ!
E pur si muove! (італ.) І все-таки вона крутиться!
Галілео Галілей, 1633 р.
Велика Фарма подарувала світу чотири найвідоміші ковід-вакцини — Pfizer-BioNTech, Moderna, Johnson&Johnson, Oxford-AstraZeneca, ефективність яких вчені продовжують досліджувати. Говорячи про захисний ефект вакцинації, люди часто плутають поняття «зараження» і «захворювання». Відомо, що жодна вакцина не може захистити від зараження — потрапляння вірусу в організм. Щеплення не створює навколо людини «захисного поля», тому, якщо вакцинований досить довго поспілкується з хворим на COVID-19 без дотримання належних засобів безпеки, вірусні частинки неминуче потраплять на слизові оболонки. Але вакцини створюють захисний пул антитіл, налаштовуючи імунну систему на зустріч із вірусом і його нейтралізацію, запобігаючи тяжким формам, госпіталізаціям, смертності, — і це науковий факт! Коли ми говоримо про захворювання, це означає, що вірус розмножився в достатній кількості, щоб спричинити масштабну реакцію імунної системи чи почати шкодити. Окрім того, ймовірність захворіти, незважаючи на щеплення, залежить від загальної ситуації з вірусом в країні і, зокрема, від кількості вакцинованих або так званого популяційного імунітету
Чим відрізняються м-РНК та аденовірусні вакцини?
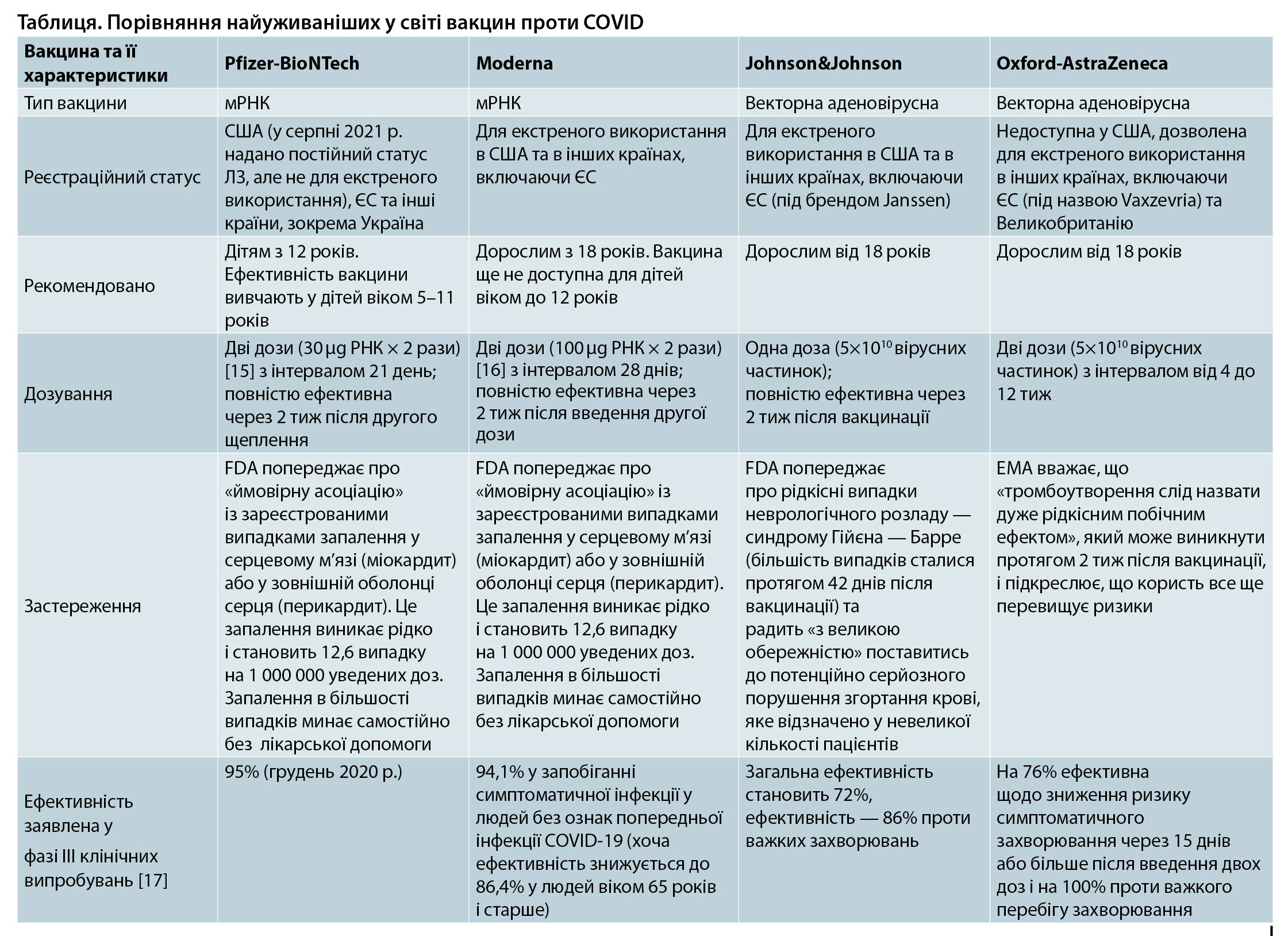
Характеристики головних ковід-вакцин представлено в таблиці. Дві вакцини з мРНК, які на сьогодні широко застосовують (BioNTech-Pfizer та Moderna), технологічно дуже схожі. Вони містять кодон-оптимізовані послідовності для ефективної експресії повнорозмірного S-білка і використовують автентичну сигнальну послідовність для його біосинтезу (рис. 1). Обидва виробника для виділення послідовності мРНК взяли за основу ідентичний уханський штам (Wuhan-Hu-1) [1].
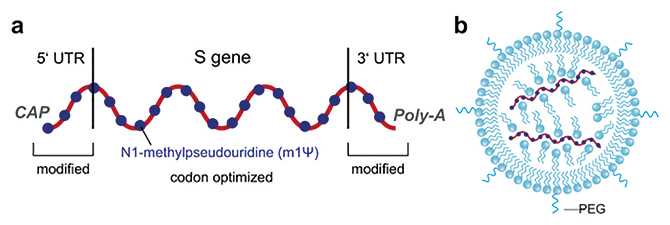
Рис. 1. Принципова схема мРНК-вакцин: а) схема мРНК-вакцини у вакцинах BionTech-Pfizer та Moderna. UTR — неперекладена ділянка; b) схема ліпосом, що використовуються для доставки мРНК-вакцин. ПЕГ (PEG) — поліетиленгліколь (рисунок запозичено та цитовано зі статті Heinz та Stiasny, 2021 [2])
На даний час широко застосовують чотири вакцини на основі аденовірусу (наведено в алфавітному порядку): CanSino Biological Inc. Пекінського інституту біотехнологій, Janssen-Johnson&Johnson, Oxford-AstraZeneca та НДІ Гамалеї (рис. 2; див. таблицю). Вони використовують похідні різних аденовірусів як вектори: CanSino — аденовірус людини 5-го типу [5], Janssen-Johnson&Johnson — аденовірус людини 26-го типу [6], Oxford-AstraZeneca — аденовірус шимпанзе Y-25 [7], НДІ Гамалеї — аденовірус людини 26-го типу для першого щеплення та аденовірус людини 5-го типу — для другого. Деякі автори вважають, що векторні вакцини мають важливий недолік, оскільки несуть не тільки генетичний матеріал коронавірусу, а й антигени векторного вірусу, що обумовлює вищу імуногенність та меншу специфічність і спричиняє продукцію й інших антитіл, які не мають відношення власне до коронавірусу [8].
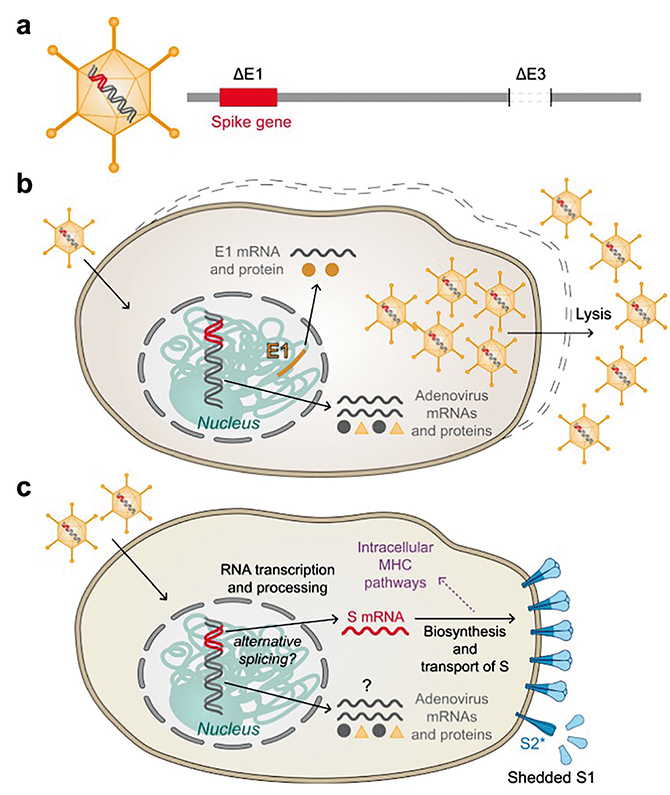
Рис. 2. Принципова схема аденовірусних вакцин: a) схема реплікаційної аденовірусної векторної частки та її ДНК. E1 та E3 — гени раннього аденовірусу 1 та 3 відповідно; b) утворення частинок вакцини у виробничій клітинній лінії, що доповнює Е1 з хромосомно інтегрованого гена Е1. Вивільнення новоутворених векторних частинок шляхом клітинного лізису; c) експресія спайку в клітинах вакцинованих осіб. Вивільнення S1 та перетворення S2 у структуру після злиття (S2*) може відбутися за відсутності стабілізувальних мутацій (рисунок запозичено та цитовано зі статті Heinz та Stiasny, 2021 [2])
Чи ефективні коронавірусні вакцини?
Усі дозволені вакцини перевершили початкові сподівання та максимальні очікування щодо захисту на 50% (див. таблицю). Разом з тим експерти продовжують вивчати ефективність різних вакцин і, зокрема, Pfizer. Початкові клінічні дані фази ІІІ вакцини Pfizer, представлені в грудні 2020 р., підтвердили, що її ефективність дорівнює 95%. У квітні компанія оголосила, що ефективність вакцини проти COVID-19 становить 91,3% на підставі розрахунку запобігання інфекуванню COVID-19 в період із 7 днів до і 6 міс після введення другої дози. Було також виявлено, що вона є ефективною щодо запобігання важкому перебігу захворювання (на 100%, за визначенням CDC, і на 95,3%, за визначенням FDA). Інше дослідження, яке ще не було рецензовано, надало дані щодо зниження ефективності вакцини до 84% через 6 міс після щеплення, хоча ефективність проти виникнення важкого захворювання утримувалась на рівні 97% [9]. У серпні 2021 р. CDC (Центр з контролю та профілактики захворювань) також опублікував дослідження, яким було встановлено, що захист від інфекції може послаблюватися, хоча вакцини все ще були високоефективними щодо госпіталізації [10]. Результати дослідження, проведеного CDC у штаті Нью-Йорк, підтвердили: ефективність вакцини знизилася з 91,7 до 79,8%, що спонукало адміністрацію Джо Байдена рекомендувати прискорення проведення щеплень.
Показовою є кампанія зі щеплення вакциною Pfizer-BioNTech в Ізраїлі. Статистика свідчить, що за підсумками 4 міс вакцинації серед щеплених із симптомами COVID-19 занедужувало в середньому 0,8 людини на 100 тис., серед нещеплених — 32,5. До лікарні через коронавірус було госпіталізовано 0,3 особи на 100 тис. серед щеплених і 4,6 — серед нещеплених. Смертність від COVID-19 серед госпіталізованих становила 0,6 на 100 тис. людино-днів серед нещеплених і 0,1 на 100 тис. — серед щеплених [11].
Чи вбережуть вакцини від ризику захворювання за наявності нових варіантів мутацій?
З моменту появи SARS-CoV-2 виникло і поширилося безліч вірусних мутацій. Деякі з них ВООЗ вважає «варіантами занепокоєння» через їхню високу контагіозність, супутню заміну раніше циркулюючих штамів та наявність мутацій у S-білках-шипах. ВООЗ вважає, що всі дозволені до застосування вакцини однаково впливають на них, оскільки в своїй основі всі вони мають вихідний штам дикого уханьського типу з ранньої фази пандемії [12]. Є дані досліджень, в яких вивчають утворення антитіл до різних доменів S та аналізують співвідношення нейтралізуючих антитіл як важливого параметра ефективності вакцини [13]. Ці дані можуть слугувати непрямим показником структурної цілісності S у вакцинах та якості імунної відповіді В-клітин. Найновіші дані щодо ефективності вакцин на момент підготовки цієї публікації стосуються дельта-варіанта або 1.617.2-штаму, вперше відкритого в Індії. Зазначимо, що ці дані постійно оновлюються, мають динамічний характер і залежать від країни, проміжку часу тощо. Донедавна ми раділи повідомленням, що лабораторні дослідження продемонстрували високу ефективність вакцини Pfizer-BioNTech, Moderna, AstraZeneca, Johnson&Johnson. Її визначають у так званій реакції нейтралізації, коли до клітин коронавірусу (точніше, не прямо його, а так званий модельний, безпечний вірус, який несе на поверхні спайк-білок і поводиться при зараженні як SARS-CoV-2) додають плазму вакцинованих. Антитіла з плазми крові перешкоджають зараженню клітин, і вчені тестують, у скільки разів можна розбавити її, щоб ефект зберігався. Для вихідних штамів плазму можна було розбавляти в 1000 разів, але штам дельта знижує цей показник у 2,5–5 разів залежно від вакцини. Тобто в крові вакцинованих, як і раніше, є великий надлишок ефективних антитіл, здатних знешкоджувати вірус, але не настільки величезний, як за часів, коли на планеті циркулювали старі варіанти вірусу. Перерахунок цифр щодо зниження ефективності нейтралізації на загальну ефективність показав, що для Pfizer-BioNTech вона мала знижуватись з 94 до 88%.
Вакцини — як Pfizer/BioNTech, так і AstraZeneca — добре захищають від тяжкого перебігу захворювання, навіть якщо людина заразилася індійським штамом. Ефективність однієї дози мРНК-вакцини щодо запобігання госпіталізації (важкого перебігу) становила 94%, двох доз — 96%. Ефективність однієї дози векторної вакцини AstraZeneca щодо запобігання госпіталізації становила 71%, двох доз — 95% [14]
Ще на початку травня у двох дослідженнях було виявлено, що вакцина Pfizer більш ніж на 95% ефективна проти важкого перебігу хвороби або смерті від альфа-варіанта (вперше виявлений у Великобританії) та бета-варіанта (виявленого в Південній Африці). Вакцина Moderna також ефективно забезпечує захист від альфа- та бета-варіантів. А дослідження, про які повідомляли в червні, продемонстрували її ефективність і проти варіантів дельта, ета та каппа, хоча її ефективність приблизно вдвічі нижча проти дельти, ніж проти оригінального вірусу.
Ізраїльські ЗМІ вимагають пояснень, або дельта плутає карти…
Ізраїльтяни заявляють, що ефективність вакцини становить зовсім не 88%, а всього 64%. То що, знову Фарма всіх обманула? Зовсім ні! Тестування вакцини проходило під час повного або часткового карантину, тож ефективність на рівні 94% визначена саме з урахуванням цих обставин. Якби обмеження зберігалися, прихід дельта-штаму знизив би її ефективність до теоретично підрахованих 88%. Але той самий Ізраїль, як і після другої хвилі, поквапився з відкриттям закладів і скасуванням маскового режиму. Вірус, зрозуміло, почав поширюватися серед неімунізованих і того невеликого відсотка щеплених, які були ним інфіковані. Як відомо, що більше вірусу «гуляє» в популяції, то вище ризик «пробою» імунітету, отриманого як внаслідок хвороби, так і завдяки вакцинації, тим більше з огляду на виникнення нових мутованих штамів
Два дослідження, результати яких були опубліковані у Великобританії та ще не пройшли експертну оцінку, показали, що повна вакцинація після введення двох доз Moderna забезпечує 88% ефективності проти захворювання та на 96% дозволяє уникнути госпіталізації. Ізраїль повідомив, що вакцина була на 90% ефективна проти важких захворювань, але наприкінці червня — на початку липня — лише на 39%. Як бачимо, ізраїльські відомості відносно дельта-штаму відповідають даним серологічних досліджень, тобто зниженню ефективності провідної вакцини у 2–2,5 раза як in vitro, так і у реальних «польових» умовах. Але цей показник залишається високим, адже вакцина забезпечує 2–2,5-кратний надлишок захисних антитіл у крові проти дельта-штаму, а це немало. Попри це, необхідні додаткові дослідження ефективності вакцини Moderna проти дельта-штаму. Деякі експерти вважають, що вона може діяти подібно до Pfizer, оскільки обидві є вакцинами мРНК.
Чи можуть вакцини генетично модифікувати людину?
Інтерес суспільства до долі чужорідної (аденовірусної або SARS-CoV-2 зворотно транскрибованої) ДНК у клітинах та організмах ссавців (людини) є вельми високим. Занепокоєння людей формулювалися на кшталт «чи потрапляє вакцина у мої гени або чи станемо ми ГМО»?
Як було зазначено вище, деякі із затверджених нині вакцин проти SARS-Coronavirus-2 (AstraZeneca/Оксфордський університет, вакцина проти коронавірусу Johnson&Johnson’s Janssen та Sputnik V) ґрунтуються на векторах аденовірусної ДНК як носіях генетичної інформації для SARS-COV-2 спайковий глікопротеїн. Вакцини, вироблені BioNTech/Pfizer або Moderna, містять месенджерну РНК (мРНК) для синтезу цього білка. Після введення вакцини мРНК ініціює синтез білка вірусного спайку безпосередньо у вакцинованих.
Геном людини є стабільним, але мінливим. Майже 50% геному людини 3×109 нуклеотидних пар представляє транспозитивні елементи, а 8% ‒‒ ендогенні ретровірусні геноми. РНК SARS-CoV-2 або її сегменти, як і ген шипа, можуть бути зворотно транскрибовані зворотною транскриптазою, кодованою LINE-1 або іншими факторами. Синтезована таким чином ДНК може бути інтегрована з невідомими частотами та місцями в геноми вакцинованих. Але це стосується і тих, хто захворів на SARS-CoV-2
У нещодавно виконаній експериментальній роботі Walter Doerfler описав дослідження на основі ДНК аденовірусу, а також навів дані про стійкість РНК/ДНК SARS-CoV-2 [18]. Автор дійшов висновку, що фактична інтеграція молекул вірусної ДНК та аденовірусної векторної ДНК, ймовірно, буде випадковою подією, частоту та епігенетичні наслідки якої наразі не можна з упевненістю оцінити. Але, як зазначає автор, інтеграція вірусної ДНК протягом еволюції людства до людського геному добре відома, зокрема, для ретровірусів, вірусів герпесу тощо. Що ж до вакцин аденовекторів, то вважають, що векторна ДНК аденовірусу досягає переважно клітин печінки [19] і потрапляє до клітин імунної системи. В огляді також розглянуто проблеми залишкової експресії аденовірусних генів у векторах та визначено їхню роль у виникненні побічних ефектів вакцин. Однак кількість ДНК-вектора аденовірусу, упакованого у віріон, що зазвичай вводять внутрішньом’язово, наприклад з вакциною AstraZeneca (50×109віріонів на дозу вакцини, що еквівалентно приблизно 2,5 мкг аденовірусної ДНК-вектора на дозу), набагато нижча, ніж у багатьох схемах генної терапії. Крім того, вірусна інфекція SARS-CoV-2 сама по собі може бути пов’язана з інтеграцією зворотних транскриптів вірусної РНК [20], як і будь-яка інша вірусна інфекція з точки зору біологічних механізмів геному, а ця серія подій може стати випадковою при будь-якій інфекції SARS-CoV-2, що описано в біології як «еволюційна випадковість». Отже, ризик розвитку небажаних подій інтеграції зворотних транскриптів РНК SARS-CoV-2 при введенні вакцини на основі мРНК виглядає подібним до такого, як і при інфекціях SARS-CoV-2 COVID-19.
Наразі не існує дієвої альтернативи вакцинації мільярдів людей, життю яких загрожує коронавірус.
Чи дозволено грудне вигодовування після вакцинації?
Група вчених з Каліфорнійського університету в Сан-Франциско з’ясувала, що в зразках молока жінок, імунізованих проти COVID-19 вакцинами BNT162b2 (Pfizer) і мРНК-1273 (Moderna), РНК були відсутні [21]. Дослідження підтримує позицію ВООЗ про необхідність продовження вигодовування після щеплення цими вакцинами.
Відносно аденовірусних вакцин даних не так багато, проте у випробуваннях векторної вакцини від Johnson&Johnson брали участь як жінки, що годують груддю, так і вагітні, і ні у кого з них не було виявлено незвичайних побічних ефектів, а імунна відповідь не відрізнялась від середнього показника в популяції.
Скільки діє вакцина?
Відповідь на це питання збігається з відповіддю на попереднє. Масова вакцинна кампанія почалася взимку 2020 — навесні 2021 р. і принаймні для мРНК-вакцини за цей період захисний ефект, мабуть, знизився незначною мірою. Проте більшість експертів вважають, що ревакцинація в тому чи іншому вигляді знадобиться, оскільки коронавірус, схоже, вже не зникне з популяції, а вакцини навряд чи забезпечать довічний імунітет.
Генеральний директор компанії Pfizer Альберт Бурла оцінив ймовірний термін, коли щепленим може знадобитися бустер (підсилює щеплення). На його думку, він становить 8–12 міс. До цифри ревакцинації у 8 міс приходять і європейські країни, але поки акцент робиться на людях із груп підвищеного ризику (пацієнти з онкологічними захворюваннями, особи старшого віку, хворі після трансплантації органів).
Чи треба робити щеплення, якщо людина перехворла на COVID-19 і в організмі у неї наявні антитіла?
Cьогодні вчені не знають, яким має бути мінімальний рівень антитіл, що забезпечує прийнятний захист від захворювання. Тому регулятори в сфері охорони здоров’я різних країн рекомендують тим, хто перехворів, щепитися (не вказуючи терміну, як, наприклад, американський CDC) або радять почекати 28 днів з моменту початку симптомів, як британський NHS.
Рекомендація щодо обов’язкового щеплення пов’язана з тим, що після хвороби імунна відповідь дуже відрізняється у різних людей. Звичайно, чим важчим був перебіг захворювання, тим вище загальний рівень антитіл і більша кількість нейтралізуючих антитіл. Вакцинація ж створює набагато стабільніший рівень антитіл, крім того, після неї не утворюються неефективні антитіла, націлені на інші білки коронавірусу, які неминуче формуються після хвороби.