Бессмертие рядовой клетки, или В поисках вечной молодости
В 2009 году американские исследователи Элизабет Блэкберн, Френсис Шостак и Кэрол Грейдер «за открытие того, как теломеры и фермент теломераза защищают хромосомы» удостоились Нобелевской премии. В сущности, лауреаты 2008 года экспериментально доказали предположение Алексея Оловникова почти сорокалетней давности. К сожалению, об этом мало кто помнит
Гипотеза биолога Оловникова
Может ли смертный организм состоять из потенциально бессмертных соматических клеток? На этот вопрос ученые отвечали по-разному.
На рубеже ХIX–ХХ веков в научном мире доминировала умозрительная концепция, выработанная немецким биологом А. Вейсманом: «…ограниченная продолжительность жизни организмов обусловлена ограниченной способностью соматических клеток к размножению». После того как были опубликованы результаты экспериментов А. Карреля (1912) и А. Эбелинга (1913), свидетельствующие о том, что в идеальных условиях соматические клетки могут размножаться бесконечно долго, сформировалось представление о потенциальном бессмертии клеток смертного организма. Позже выяснилось, что эксперименты, мягко говоря, проводились не совсем корректно, но на протяжении нескольких десятилетий «миф Карреля», так сегодня называют концепцию потенциального бессмертия клеток, был весьма популярен. На сообщения, явно «не вписывающиеся» в эту концепцию, просто не обращали внимания, считая их исключением из правил.
В конце 50-х годов ХХ века Э. Свим, проанализировав 336 публикаций и собственные экспериментальные данные, показал, что в действительности исключением из правил является «неограниченная способность клеток животных к делению, причем во многих случаях неограниченно делящиеся клетки уже мало напоминают по морфологии и ростовым характеристикам исходные нормальные клетки». Казалось бы, работа Э. Свима должна была возродить интерес к гипотезе А. Вейсмана, но этого не произошло. Как полагают некоторые исследователи, Э. Свим не проявил «необходимой активности в пропаганде своих выводов». Его коллега Л. Хейфлик оказался более удачливым или, как некоторые считают, более предприимчивым.
В 60-х годах Л. Хейфлик экспериментально показал, что «фибробласты эмбрионов человека в культуре делятся 50±10 раз: фибробласты, взятые от момента рождения до 20 лет, делятся 30±10 раз, а клетки, взятые у доноров старше 20 лет, делятся 20±10 раз» и затем гибнут. Исходя из этого, он предположил, что «момент, когда наступает потеря заложенного в клетках потенциала делений, может определять предел продолжительности жизни человека».
По сути, Л. Хейфлик лишь подтвердил выводы Э. Свима и гипотезу А. Вейсмана. Но о концепции А. Вейсмана и об изысканиях Э. Свима знали единицы, о статьях Л. Хейфлика — если и не все, то многие ученые. Неудивительно, что ограниченную способность клеток к делению называют «лимитом Хейфлика», а сам феномен ассоциируется с первым и окончательным опровержением «мифа Карреля».
Известный российский биолог-теоретик Алексей Оловников связал «лимит Хейфлика» с присутствием в клетках некоего «молекулярного бухгалтера», который контролирует число делений», и выдвинул гипотезу, поясняющую, как он это делает. В авторском изложении суть гипотезы заключается в следующем.
Деление клеток — это, по сути, удвоение ДНК. ДНК — это рельсы. По ДНК при клеточном делении продвигается специальный фермент ДНК-полимераза, который делает копии (реплики) ДНК. Полимераза движется, как ведущий вагон поезда. Но у ДНК, как и у рельсов, есть конец. Как и ведущий вагон, ДНК-полимераза упирается в тупик.
Предположим, что в середине ведущего вагона, как и ДНК-полимеразе, есть каталитический центр, который касается рельсов и делает копию, но до конца рельсов не доходит. Это означает, что концевые участки ДНК, или теломеры, с каждым делением будут становиться все короче и короче. Следовательно, должна существовать корреляция между размерами теломер и числом проделанных клетками делений.
Геронтологи не исключают, что в будущем с помощью теломеразы можно будет «регенерировать ткани, приводя их в более здоровое состояние», правда, не уточняют, когда это будущее наступит
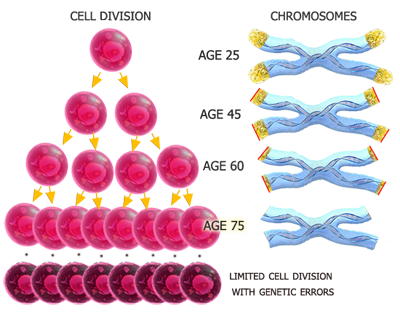 Вместе с тем А. Оловников полагал, что природа должна была изобрести фермент, компенсирующий действие ДНК-полимеразы и препятствующий укорочению концевых участков ДНК.
Вместе с тем А. Оловников полагал, что природа должна была изобрести фермент, компенсирующий действие ДНК-полимеразы и препятствующий укорочению концевых участков ДНК.
К такому же умозаключению пришел и Джеймс Уотсон, тот самый Уотсон, который вместе с Фрэнсисом Криком создал модель молекулы ДНК, правда, на год позже Алексея Оловникова, если, конечно, судить по датам публикаций.
Нобелевский триумвират
Российские коллеги не нашли «логических проколов» в гипотезе Оловникова, тем не менее проверить ее отказались, поскольку сочли неправомерной. Дескать, «геном стабилен и укорачиваться не может». Словом, воспользовались классическим аргументом: этого не может быть, потому что не может быть никогда. Впрочем, и Л. Хейфлику та же догма помешала связать лимит деления с ДНК. По иронии судьбы «проницательное предположение Оловникова получило блестящее экспериментальное подтверждение» благодаря его (Хейфлика) соотечественникам, будущим нобелиатам.
В 1980 году Элизабет Блэкберн экспериментальным путем установила, что теломеры инфузории Tetrahymena состоят из многократно повторяющихся блоков, причем довольно коротких, включающих всего шесть нуклеотидов.
В тот момент Ф. Шостак без особого успеха пытался «перепрограммировать» клетки дрожжей, вводя в них искусственные хромосомы. Состав хромосом менялся, но результат оставался неизменным — хромосомы быстро разрушались.
Работа Блекберн заинтересовала Шостака, и он предложил провести совместный эксперимент: выделить теломеры инфузории, присоединить их к искусственным хромосомам и модифицированные таким образом хромосомы ввести в дрожжевые клетки. Результаты, полученные два года спустя, оправдали ожидания Шостака: «пришитые» теломеры действительно защищали искусственные хромосомы от внутриклеточной деградации.
Еще через два года аспирантка Блэкберн, Кэрол Грейдер, нашла фермент, компенсирующий укорочение теломер, точнее, сначала зарегистрировала искомую ферментативную активность в клеточном экстракте, а затем выделила сам фермент и установила, что в его состав входит не только белок, но и рибонуклеиновая кислота, которая выступает в качестве «шаблона» при достройке теломер, реализуемой белковой частью фермента.
Как нетрудно догадаться, фермент назвали теломеразой. Продолжая изучать роль теломер в клетке, Шостак установил, что дрожжевая культура с мутацией, приводящей к постепенному укорачиванию теломер, развивается очень медленно и в конце концов прекращает расти. Блэкберн обнаружила, что точно так же ведут себя инфузории, имеющие мутации в теломеразной РНК, а Грейдер доказала, что те же механизмы «работают» и в клетках человека.
Открытия будущих нобелиатов не остались незамеченными. Достаточно вспомнить заявления ученых о том, что укорачивание теломер влечет за собой не только гибель соматических клеток (в половых клетках теломеры не укорачиваются), но и старение организма, и что с помощью теломеразы можно существенно увеличить потенциал деления клеток и тем самым омолодить организм.
Преодолеть «лимит Хейфлика» действительно удалось. Процессы старения организма не до конца понятны. Единственное, что не вызывает сомнений, — помимо укорачивания теломер в них задействованы и другие механизмы.
И все-таки геронтологи не исключают, что в будущем с помощью теломеразы можно будет «регенерировать ткани, приводя их в более здоровое состояние», правда, не уточняют, когда это будущее наступит.
Пожалуй, самой удачной можно считать идею лечения онкобольных препаратами на основе ингибиторов теломеразы. С одной стороны, в отличие от большинства нормальных соматических клеток организма клетки многих злокачественных опухолей практически бессмертны благодаря присутствию в них теломеразы. С другой стороны, блокирование работы теломеразы приводит к укорачиванию хромосом и, как следствие, к гибели клетки. Более того, калифорнийской биотехнологической компании «Geron Corporation» удалось создать препарат (GRN163L), подавляющий теломеразную активность за счет связывания с РНК-шаблоном фермента. Сегодня новое противораковое средство с рабочим названием GRN163L находится в стадии клинических испытаний.
Ламара Львова, канд. биол. наук
“Фармацевт Практик” #01′ 2010
