Вакцинація «генами»: як це відбувається і чи допоможе у боротьбі з COVID-19
Можливість створення вакцин на основі ДНК або РНК, що кодують протективні антигени інфекційних агентів, була доведена ще у 90-ті роки минулого століття, коли маніпуляції з генами стали для науковців рутиною. Використання генів здавалося простим, зручним та безпечним підходом до імунізації. З того часу численні ДНК- та РНК-вакцини вивчали більше ніж у 500 клінічних випробуваннях, але жодна з них так і не була зареєстрована. Можливо, форс-мажорна ситуація через пандемію коронавірусної хвороби COVID-19 зрушить справу, і людство нарешті скористається перевагами ДНК- та РНК-вакцин
Традиційно для створення вакцин проти тієї чи іншої інфекційної хвороби використовують збудника цієї хвороби — живого, ослабленого або інактивованого (вбитого). Живі вакцини (наприклад, проти кору, краснухи, паротиту, поліомієліту) є найефективнішими щодо розвитку імунної відповіді, але з ними існує купа проблем — від реверсії вірулентності до умов зберігання. Інактивовані вакцини, до яких належать вакцини проти коклюшу, сказу, гепатиту А, більш стабільні, але й відповідь на них слабша, тому вони потребують проведення кількох ревакцинацій. Ще варіант — «хімічна вакцина»: така містить антигенні компоненти патогена (наприклад, фрагменти клітинної стінки бактерії) та може зумовити імунну відповідь проти нього, як це роблять ацелюлярна вакцина проти коклюшу, кон’югована вакцина проти гемофільної інфекції або менінгококова вакцина. Розвиток біотехнологій дозволив, з одного боку, створювати живі вакцини на основі генетично-модифікованих збудників, а з іншого — взагалі уникнути культивування в промислових масштабах небезпечних патогенних бактерій та вірусів, натомість запропонувавши синтез білкових антигенів у генетично-модифікованих мікроорганізмах. Такі біосинтетичні вакцини добре переносяться, але, на жаль, мають нижчу імуногенність, ніж живі вакцини. До того ж через високу мінливість збудників, першою чергою вірусів, біосинтетичні вакцини, які зумовлюють імунну відповідь вузької специфічності, можуть досить швидко втрачати захисні властивості.
Вакцина має бути безпечною та стабільною, але при цьому створювати стійкий імунітет після мінімальної кількості введень. Крім того, вона не повинна бути дорогою, адже це перешкоджатиме її масовому використанню. Не дивно, що розробка, випробування та виробництво вакцин — дуже складні завдання, що потребують купу часу та ресурсів.
Теоретично значно полегшити розробку та виробництво вакцин може використання для вакцинації не цілих збудників, не їхніх білків, а фрагментів ДНК та РНК, що кодують протективні антигени бактерії або вірусу, тобто такі антигени, імунна відповідь на які забезпечить формування стійкого імунітету проти даного збудника. Уявіть: вже не потрібно культивувати небезпечні мікроорганізми, обирати штами з певними властивостями, робити з ним щось, аби ослабити та очистити від баласту, також не потрібно шукати на поверхні особливо імуногенні фрагменти, виділяти їх та ретельно очищати. Натомість достатньо розшифрувати гени структурних білків збудника, після чого їх можна легко клонувати, за потреби — модифікувати, і випробовувати з метою з’ясування безпеки та імуногенності.
Інтерес до ДНК- та РНК-вакцин активізувався ще до появи COVID-19. Він пов’язаний з успіхами застосування плазмід та РНК у генній терапії, а також зі створенням більш ефективних конструкцій для доставки вакцинних генів у клітини. Але саме COVID-19 спричинив потужні інвестиції у розробку і вдосконалення ДНК- та РНК-вакцин та, можливо, забезпечить їм клінічне майбутнє.
ДНК-вакцини
У ДНК-вакцині діючою речовиною є ДНК, що несе ген одного або декількох протективних антигенів збудника інфекційної хвороби. Зазвичай це гени поверхневих білків вірусу або бактерії. Після введення ДНК-вакцини людині або тварині гени мають потрапити в її клітини та забезпечити там синтез відповідного білка, який, своєю чергою, зумовить імунну відповідь.
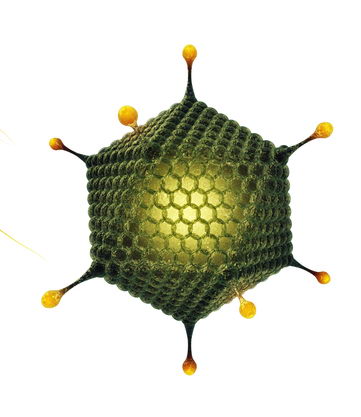
Модель частинки аденовірусу. Аденовіруси використовують як вектори для доставки вакцинної ДНК
Щоб ген (трансген) потрапив у клітину і там відбулася його експресія, його, звісно, треба відповідним чином «спорядити», наприклад, вбудувати в плазміду — кільцеву ДНК, здатну до автономної реплікації. Плазміда повинна містити еукаріотичний промотор (який розпізнають ферменти транскриптази та почнуть синтез мРНК), гени-посилювачі транскрипції, сайти припинення транскрипції, а також, можливо, сайти реплікації, що забезпечать копіювання вакцинної ДНК. Також вакцинний ген можна доставити у клітину за допомогою вірусного вектора, тобто вірусу, який це добре вміє та містить у своєму геномі все необхідне для експресії власних генів. Звичайно, вірус має бути абсолютно безпечним: для цього його позбавляють генів вірулентності та залишають лише гени, необхідні для проникнення в клітину та запуску транскрипції і реплікації власного геному. Ці два типи векторів можна поєднати і використати для доставки генів плазміди, що містять геноми атенуйованих вірусів.
Коли тварині або людині вводять ДНК-вакцину, плазміда чи вірусний вектор проникає в клітини, наприклад, міоцити або клітини імунної системи, та потрапляє в ядро, де відбувається транскрипція і утворюється мРНК. Остання виходить у цитоплазму, де на ній, як на матриці, синтезується білок-антиген, що може покинути клітину, а може в комплексі з білками головного комплексу гістосумісності (MHC I або MHC II) бути презентованим на її поверхні. Останнє є сигналом для імунної системи, що з клітиною трапилась біда: фагоцити поглинають її та вже самі презентують на поверхні чужорідний «вакцинний» антиген. Це дає сигнал Т-лімфоцитам взятися до справи. Іноді для посилення імунної відповіді в плазміду із трансгеном вбудовують також гени цитокінів, хемокінів та інгібіторів імуносупресії.
При створенні ДНК-вакцин вчені часто стикаються з такими проблемами:
- низький рівень трансфекції людських клітин in vivo, тобто мала кількість ДНК, що потрапляє в клітини після введення ДНК-вакцини;
- слабка імуногенність ДНК-вакцин;
- необхідність повторних бустерних вакцинацій для формування стійкого імунітету.
Останні два пункти є проблемою для більшості вакцин, що не містять живого збудника.
При тестуванні ДНК-вакцини важливо ретельно дослідити: чи існує ризик вбудовування вакцинної ДНК у хромосоми людини; чи можливий розвиток автоімунних реакцій, наприклад, проти клітин, які синтезують вакцинний антиген; як довго вакцинна ДНК наявна та експресується в різних тканинах.
Читайте також: Инновационные подходы для обеспечения быстрого доступа к лекарственным средствам в условиях эпидемии COVID-19
РНК-вакцини
РНК-вакцина містить мРНК, на якій після потрапляння в клітину відбувається синтез білкового антигена. РНК-вакцина може бути просто молекулою мРНК, не здатною до самовідтворення (реплікації). Така мРНК зазвичай кодує лише один антиген, але також повинна містити на кінцях певні послідовності для ефективної трансляції та захисту від нуклеаз.
При створенні РНК-вакцини можна також використати гени якого-небудь одноланцюгового РНК-вірусу: це дозволяє отримати РНК-реплікони — конструкції, що здатні не лише запустити синтез антигену, а й власну реплікацію. Завдяки цьому можна отримати в клітині більше молекул мРНК та відповідно синтезувати більше антигену і посилити імунну відповідь.
Молекула вакцинної РНК може потрапити в клітину людини або тварини за допомогою клітинно-специфічних механізмів, наприклад, піноцитозу. В цитоплазмі відбувається синтез білка, який, як і у випадку ДНК-вакцин, повинен бути презентований імунній системі організму разом із білками MHC I та MHC II.
Основною проблемою РНК-вакцин є їхня нестабільність, взагалі притаманна РНК, а також недостатня ефективність наявних систем доставки.
Вакцини проти COVID-19
У грудні 2019 р. в Китаї виявили перші випадки нової коронавірусної інфекції, пізніше названої COVID-19, а вже 11 січня 2020 р. у відкритому доступі було опубліковано розшифрований геном вірусу-збудника SARS-CoV-2. Це стало початком інтенсивної роботи десятків лабораторій по всьому світу зі створення вакцини. Створити ДНК- або РНК-вакцину-кандидата, коли відомі гени структурних білків збудника, можна буквально за кілька тижнів, але тести для визначення її безпеки та клінічні випробування скоротити неможливо. Тому в лютому ВООЗ заявила, що не варто сподіватися отримати вакцину проти SARS-CoV-2 раніше ніж через 18 міс.
Треба зазначити, що спроби створити вакцини проти інших небезпечних коронавірусів — тих, що спричиняють SARS та MERS, — зазнали невдач на ранніх стадіях клінічних випробувань. Внаслідок того, що спалахи цих хвороб вдалося швидко локалізувати, фінансування даних проєктів припинилося, отже, поки що вакцин проти будь-яких коронавірусів у світі немає.
Глобальне поширення коронавірусу SARS-CoV-2 сприяло залученню до розробки вакцини міжнародних альянсів та величезних обсягів фінансування від держав, фармкомпаній, благодійних фондів, приватних осіб. Завдяки цим зусиллям вже в березні розпочалися випробування за участі людей чотирьох вакцин-кандидатів. Наприклад, фонд «Коаліція за інновації у сфері готовності до епідемій» (CEPI), заснований у 2017 р. подружжям Біла та Мелінди Гейтс для запобігання поширенню небезпечних хвороб, зібрав на створення вакцини проти COVID-19 близько 2 млрд доларів. Наразі фонд фінансує декілька наукових груп і його розглядають як одного із «ключових гравців у перегонах з розробки вакцини проти COVID-19». У квітні представники СЕРІ оголосили, що завдяки прискореній процедурі розгляду заявок вакцина може бути схвалена вже в перші місяці 2021 р.
Загалом на початок червня 2020 р. у світі заявлено про розробку 159 вакцин проти COVID-19. Із них три створені на основі ослаблених живих вірусів SARS-CoV-2; сім — на основі інактивованого вірусу та ще сім — вірусоподібних частинок; 47 містять білкові субодиниці оболонки вірусу; решта — це ДНК- та РНК-вакцини. Експерти CEPI вважають, що останні є найбільш перспективними, адже надають можливість:
- легко модифікувати вірусні гени задля збільшення імуногенності їхніх продуктів;
- швидко оцінювати якість вакцини;
- швидкого масового виробництва.
Зі 159 вакцин-кандидатів чотири проходять клінічні випробування фази І (безпека та попередня оцінка впливу різних доз у людей), п’ять — фази І–ІІ (безпека та імуногенність), дві — фази ІІ (імуногенність, ефективність різних доз, побічні ефекти). Серед кандидатів, що вже успішно пройшли фазу І та наразі розпочали фазу ІІ:
- ДНК-вакцина Ad5-nCoV, яка є геном S-білка коронавірусу SARS-CoV-2 (spike-білок утворює характерні шипи на поверхні вірусної частинки) в аденовірусному векторі типу 5. Це спільна розробка компанії CanSino Biologics та Пекінського інституту біотехнології Військової медичної академії (Китай). Звіт про результати випробувань фази І опублікований в журналі The Lancet (F.-C. Zhu et al., 2020);
- РНК-вакцина mRNA-1273, яка є мРНК S-білка коронавірусу SARS-CoV-2 у ліпідних наночастинках. Це розробка компанії Moderna та Центру дослідження вакцин Американського національного інституту алергічних та інфекційних захворювань (США). Звіт про результати випробувань фази ІІ очікується.
У клінічні дослідження фази ІІ обох зазначених вакцин-кандидатів будуть включені особи віком старше 60 років, адже це одна з категорій населення, що особливо потребує захисту від COVID-19 через високий ризик тяжкого перебігу захворювання.
Залишається вірити, що ДНК- та РНК-вакцини не підведуть людство у тяжкі часи та вже у 2021 р. ми матимемо надійний захист проти COVID-19.
Підготувала Тетяна Ткаченко,
канд. біол. наук
“Фармацевт Практик” #6′ 2020