Эта удивительная «супрамолекулярная химия»
Одним из приоритетных направлений современной фармакологии является исследование возможностей использования различных «контейнеров» для доставки молекул лекарственного вещества к органу-мишени. Все более мощным инструментом получения молекулярных конструкций, которые могут служить «транспортным средством», становится так называемая супрамолекулярная химия, обладающая перспективами самого широкого применения не только в медицине, но и в других областях
«Секрет» валиномицина
Еще в 1955 г. австрийский исследователь Г. Брокман из экстракта штамма бактерий Streptomyces fulvissimus впервые выделил антибиотик валиномицин, а в 1963 г. была определена его химическая структура. Стало известно, что валиномицин представляет собой депсипептид, свернутый в кольцо, которое содержит 12 остатков.
Прошло всего несколько лет, и слово «валиномицин», ранее известное лишь узкому кругу специалистов, изучающих пептиды, внезапно заполонило страницы биологических журналов. Началось это с открытия способности валиномицина стимулировать перенос ионов калия через биологические мембраны. Вскоре американцы П. Мюллер и Д. Рудин предположили, что валиномицин играет роль контейнера для переноса ионов. Согласно их гипотезе, ион калия переправляется через мембрану, «спрятавшись» внутри гораздо большей по размеру молекулы этого антибиотика.
 Термин «супрамолекулярная химия» был введен Ж.-М. Леном и определен им как «…химия за пределами молекулы, описывающая сложные образования, которые являются результатом ассоциации двух (или более) химических частиц, связанных вместе межмолекулярными силами»
Термин «супрамолекулярная химия» был введен Ж.-М. Леном и определен им как «…химия за пределами молекулы, описывающая сложные образования, которые являются результатом ассоциации двух (или более) химических частиц, связанных вместе межмолекулярными силами»
Изучением закономерностей связи между структурой и функцией валиномицина, а также родственных ему веществ занялась группа российских ученых под руководством Ю.А. Овчинникова. Вскоре вслед за валиномицином удалось обнаружить и другие, подобные ему вещества природного происхождения, которые получили в науке название «ионофоры». Благодаря их открытию и изучению был сделан решающий шаг в познании механизмов переноса ионов сквозь биологические мембраны, поскольку создаваемая ионными насосами разность концентраций ионов Nа+ и К+ по обе стороны мембран играет ключевую роль в проведении нервного импульса, регуляции осмотического давления и водно-солевого обмена.
Читайте также: Новые парадигмы классической фармакотерапии
«Короны» бывают разными
Толчком к дальнейшему развитию идеи макроциклического комплексообразования послужило открытие краун-эфиров — первых синтетических аналогов природных веществ, осуществляющих перенос ионов щелочных металлов через клеточную мембрану. Автором этого открытия стал Чарльз Педерсен, который еще в 1962 г. синтезировал соединение, представляющее собой полое внутри подвижное кольцо из углеродных атомов, связанное через мостики атомами кислорода. Форма таких молекул напоминает корону, что и определило их название (англ. crown — корона). Варьируя размер цикла, ученый установил, что краун-эфиры способны избирательно связывать некоторые катионы, помещая их в центр своей «короны», однако целых пять лет не спешил публиковать полученные результаты, а синтезировал все новые и новые соединения. В общей сложности Ч. Педерсен к 1967 г., к моменту первой публикации в журнале Американского химического общества, синтезировал более 60 полиэфиров с числом кислородных атомов от 4 до 20 и размером цикла от 12- до 60-членного.
Ныне краун-соединения становятся действенным инструментом регулирования процессов переноса металлов через биологические мембраны. В частности, это создает основу и для разработки лекарств, направленных на борьбу с заболеваниями, вызванными избытком тяжелых металлов в организме, или для выведения из организма опасных радиоактивных ионов, таких как цезий-137.
Читайте также: Медицина й хімія: користь нового погляду
«Чаши» для ионов
Открытие Чарльза Педерсена получило развитие в работах американца Дональда Крама и француза Жан-Мари Лена, что завершилось присуждением в 1987 г. всем троим Нобелевской премии.
Краун-эфиры обладают двухмерной структурой, но Д. Краму удалось получить аналогичного рода трехмерные структуры, способные захватывать ионы. В результате сложных многостадийных органических синтезов в начале 80-х годов прошлого столетия он создал так называемые молекулы-«контейнеры» с заранее организованной структурой — сферанды (буквально пустые внутри сферические структуры) и молекулы, обладающие внутренней полостью, — кавитанды (англ. cavity — полость), своего рода молекулярные чаши с углублениями. В этих чашах, так же как и в молекулах краун-эфиров, могли «вольготно» размещаться ионы.
Д. Крам установил, что в отличие от относительно гибких молекул краун-эфиров в растворе жесткие молекулы сферанда или кавитанда, в силу особенностей своей трехмерной структуры, проявляют более сильное связывание с ионами и превосходную катионную селективность.
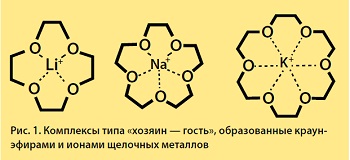
Теперь заключенный в сферанду или кавитанду катион металла оказывается в «крепких объятиях», однако с той особенностью, что они открыты лишь для данного рода катионов. Селективность связи сферанда с катионом натрия (Na+) на 10 (!) порядков величины выше его сродства к катиону калия (K+).
Огромная заслуга Д. Крама состоит в том, что он ввел в науку новую концепцию «хозяин — гость». Свою Нобелевскую лекцию в Стокгольме он так и озаглавил: «Получение молекулярных комплексов типа «хозяин — гость». В ней речь шла о способности большой молекулы («хозяина») специфически «захватывать» и прятать в своем молекулярном «чреве», если можно так выразиться, «гостя» — ион того или иного знака или даже целую небольшую молекулу.
Читайте также: Рождение лекарства: доклинические исследования
Что могут «скрывать» криптанды?
Ж.-М. Лен также осуществлял попытки создать искусственные химические соединения, обладающие свойствами природных ионофоров. Поиск таких соединений он начал в 1968 г. В результате были синтезированы особы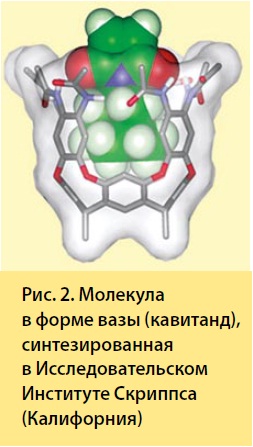 е молекулярные структуры — криптанды.
е молекулярные структуры — криптанды.
Как и Д. Крам, Ж.-М. Лен хотел сконструировать трехмерный аналог краун-эфиров. Он предвидел, что с помощью таких структур ионы металлов могут быть полностью капсулированы внутри краун-подобного «хозяина», что должно было привести к повышению катионной селективности молекулы-«хозяина» и усилению его ионофороподобных транспортных свойств.
Криптанды получили свое название благодаря способности сферически окружать, как бы «погребать в склепе», ионы металлов (греч. kruptos — «скрытый»). Ассоциация со склепом обусловлена наличием у этих соединений внутренней полости, защищенной с трех сторон атомами кислорода.
Было также доказано, что криптанды можно приспособить и для «захватывания» уже не катионов, а анионов.
И природные и синтетические
Таким образом, в конце прошлого века на стыке органической, физической, координационной химии, биологии, физики, материаловедения и микроэлектроники родилась наука под названием «супрамолекулярная химия».
Интересно отметить, что супрамолекулярные структуры очень широко распространены в живой природе. Все реакции в живых организмах протекают с участием ферментов — катализаторов белковой природы. Ферменты — идеальные молекулы-хозяева. Активный центр каждого фермента устроен таким образом, что в него может попасть только то вещество (субстрат), которое соответствует ему по размерам и энергии; с другими субстратами фермент реагировать не будет. Так, например, с помощью особых ферментов морские птицы могут опреснять для себя соленую воду.
Еще одним примером супрамолекулярных биохимических структур могут служить молекулы ДНК, в которых две полинуклеотидные цепи комплементарно связаны друг с другом посредством множества водородных связей. Каждая цепь является одновременно и гостем, и хозяином для другой цепи.
На сегодня насчитывается несколько классов синтетических супрамолекулярных соединений, среди которых основными являются кавитанды, криптанды, каликсарены, комплексы «гость — хозяин», ротаксаны, катенаны и клатраты.
Появляются все более и более сложные структуры, которые в соответствии с «ассоциациями», вызываемыми у открывших их ученых, подчас получают замысловатые названия типа «корзины», «щетки», «осьминоги» и др.
Читайте также: Что мы знаем о каротиноидах?
Супрамолекулярные структуры являются основой многих современных технологий, таких как экстракция биологически активных веществ, создание фото- и хемосенсоров, разработка нанокатализаторов, моделирование сложных биологических процессов и др. Что же касается фармакологических аспектов, то здесь новейшие технологии за счет взаимодействия «гость — хозяин» позволяют помещать в полости молекулярных контейнеров различные лекарственные вещества (пептиды, олигонуклеотиды, аминокислоты, антигены, антибиотики, цитостатики и др.) и избирательно доставлять их в клетки, ткани и органы человека. Такой подход не только повышает терапевтический эффект, но и уменьшает выраженность побочных эффектов доставляемых лекарств.
Таким образом, вышеизложенное является еще одним из ярких примеров того, как сотрудничество химии и медицины дает блестящие результаты в разработке и внедрении новейших технологий лечения различных заболеваний.
Подготовил Руслан Примак, канд. хим. наук
“Фармацевт Практик” #7-8′ 2015
