«Многоликая» молекула сероводорода: от канализаций до лечения артериальной гипертензии
В последнее время молекула сероводорода стала объектом пристального внимания ученых, поскольку среди огромного разнообразия биологических функций этой молекулы особенно важна ее роль в регуляции работы сердечно-сосудистой системы и, в частности, формировании артериального давления. Можно считать, что положено начало отдельному направлению в фармакологии — поиску и созданию принципиально новой группы антигипертензивных препаратов, действие которых основывалось бы на высвобождении молекулы сероводорода
От канализации Парижа — до сигнальной молекулы
Первые упоминания о сероводороде (H2S) принято относить к 1700 г., когда итальянский врач Бернардино Рамаццини в своем труде «О болезнях ремесленников. Рассуждение» сообщил о случаях отравления этим газом. В главе «Заболевания уборщиков туалетов и выгребных ям» он описал болезненное воспаление глаз, которое было распространено среди таких рабочих. Воспаление это часто приводило к присоединению вторичной инфекции, а иногда и к полной слепоте. Рамаццини предположил, что во время работы из разрушенных экскрементов выделяются неизвестные летучие кислоты, которые и являются первопричиной этих явлений, и советовал «чистильщикам клоак» натягивать на голову прозрачные бычьи пузыри.
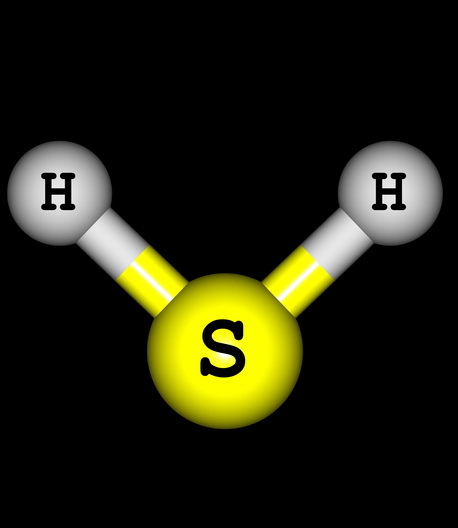 Научным подходом к изучению H2S можно считать 1775 г., когда молодой швед Карл Шееле, только начавший карьеру химика-фармацевта, обнаружил, что взаимодействие неорганических кислот с железа сульфидом (пиритом) или нагревание серы в атмосфере водорода может привести к образованию удушающего серного газа с резким запахом тухлых яиц.
Научным подходом к изучению H2S можно считать 1775 г., когда молодой швед Карл Шееле, только начавший карьеру химика-фармацевта, обнаружил, что взаимодействие неорганических кислот с железа сульфидом (пиритом) или нагревание серы в атмосфере водорода может привести к образованию удушающего серного газа с резким запахом тухлых яиц.
В 1777 г. в Париже произошел целый ряд несчастных случаев в связи с выделением газа из канализационных систем. Столетием позже Виктор Гюго описал эти события в романе «Отверженные», где назвал канализационную систему Парижа «утробой Левиафана».
В 80-х годах прошлого столетия H2S был обнаружен в тканях головного мозга, однако первоначально его сочли за артефакт, который образовался вследствие быстрого повышения концентрации сульфидов в тканях после смерти. Появление H2S связывали с его высвобождением из дисульфидных соединений серы во время препарирования тканей [1].
Рассматривать же H2S в качестве сигнальной молекулы, которая не только является токсичным агентом, но и участвует в регуляции функциональной активности различных клеток нашего организма, начали только в конце XX в. Пионерами исследований в этой области стала группа японских ученых, которые в 1996 г. впервые описали возможность синтеза H2S в тканях головного мозга и указали на его способность регулировать функции клеток [2].
В настоящее время H2S отнесен к группе так называемых газотрансмиттеров — газообразных внутриклеточных сигнальных молекул, выполняющих в клетке специфические регуляторные функции. Другими молекулами, входящими в группу газотрансмиттеров, являются хорошо известный азота монооксид (NO), а также углерода монооксид (СО).
Когда количество переходит в качество
Как химическое соединение H2S является сильным восстановителем. Его молекула, будучи липофильной, свободно проникает через мембраны клеток, чем и обусловлен основной механизм вызываемой им острой интоксикации. Он связывается в геме с железом фермента цитохром-с-оксидазы, которая теряет активность, в результате чего в митохондриях останавливается окислительное фосфорилирование и нарушается клеточное дыхание. Хотя бактериальная флора кишечника и поставляет H2S, он не проникает в кровь, так как ферменты кишечного эпителия разрушают сульфиды. Это защищает клетки от высоких локальных концентраций H2S и предотвращает проникновение газа в систему кровообращения.
Какую функцию выполняет эндогенный H2S в живых объектах, зависит от его количества: в миллимолярных концентрациях он служит для анаэробных бактерий донором электронов и энергетическим субстратом (хемосинтез); на микромолярном уровне у аэробных организмов регулирует окислительно-восстановительный баланс, а при еще более низком содержании работает как сигнальная молекула у прокариот и эукариот.
Механизмы регулирования артериального давления
Согласно данным многочисленных исследований одной из систем, где H2S играет ключевую роль как сигнальная молекула, является сердечно-сосудистая система, в частности — кровеносные сосуды. Воздействуя на сосуды артериального русла, H2S принимает непосредственное участие в регуляции артериального давления [3, 4].
Читайте также: «Секреты» сосудистого тонуса
В условиях in vitro донор H2S натрия гидросульфид (NaHS), активно используемый в экспериментальной практике, также вызывал расслабление различных отделов артериального и венозного русла: грудной, мезентериальной, почечной артерий, аорты, воротной вены и т.д. Несмотря на существенную роль эндотелия в регуляции сосудистого тонуса, его удаление не оказывало значимого влияния на эффекты H2S в гладкомышечных клетках [1], что свидетельствует о его прямом влиянии на эти клетки через присущие им регуляторные механизмы.
Газотрансмиттеры — газообразные внутриклеточные сигнальные молекулы, выполняющие в клетке специфические регуляторные функции
Расслабляющее действие H2S на гладкомышечные клетки связано преимущественно с открыванием имеющихся в структуре их мембран калиевых каналов, чувствительных к концентрации внутриклеточного источника энергии — аденозинтрифосфата (АТФ). Связываясь с серосодержащими группами белков этих каналов, H2S изменяет их пространственную конфигурацию и тем самым способствует открыванию каналов, что, в свою очередь, приводит к увеличению выхода ионов калия из клетки в межклеточную среду. В то же время активация АТФ-чувствительных калиевых каналов сопровождается инактивацией потенциал-чувствительных кальциевых каналов L-типа, обеспечивающих поступление ионов кальция (Са2+) в клетку. Высокая внутриклеточная концентрация Са2+ является необходимым условием развития сократительного ответа со стороны мышечной клетки. Закрывание кальциевых каналов способствует снижению концентрации свободного внутриклеточного Са2+ [4]. Эти процессы в совокупности запускают механизмы расслабления в гладкомышечных клетках, что приводит к снижению тонуса кровеносных сосудов и уровня артериального давления в целом.
В регуляции релаксирующего действия H2S участвуют также и другие внутриклеточные молекулярные механизмы, однако их роль не столь выражена и однозначна [3].
В ряде исследований была отмечена интересная особенность H2S — его способность в низких концентрациях вызывать сокращение гладкомышечных клеток. Согласно одной из гипотез H2S связывается с хорошо известной эндотелиальной сигнальной молекулой азота оксидом, снижая тем самым его концентрацию [5]. Снижение концентрации этих двух расслабляющих сосуды молекул является причиной повышения тонуса сосудов артериального русла.
В поисках новых терапевтических препаратов
Учитывая роль H2S в регуляции тонуса кровеносных сосудов, ученые всего мира активно взялись за разработку лекарственных средств, действие которых основывалось бы на повышении или снижении в крови концентрации этого газотрансмиттера. Возможных «кандидатов» на роль таких средств можно разделить на две группы: молекулы, которые при растворении непосредственно высвобождают H2S (NaHS, Na2S, GYY4137), и молекулы-предикторы эндогенного синтеза H2S (N-ацетилцистеин, L-цистеин) [6]. Молекулы-претенденты должны обладать рядом свойств: прежде всего быть хорошо растворимыми в воде; кроме того, не оказывать токсического действия и быстро метаболизироваться в организме; наконец, обладать пролонгированным действием, что возможно при достаточно медленном высвобождении H2S молекулой-донором в условиях in vivo.
Какую функцию выполняет эндогенный H2S в живых объектах, зависит от его количества: в миллимолярных концентрациях он служит для анаэробных бактерий донором электронов и энергетическим субстратом (хемосинтез); на микромолярном уровне у аэробных организмов регулирует окислительно-восстановительный баланс, а при еще более низком содержании работает как сигнальная молекула у прокариот и эукариот
В настоящее время в экспериментальной практике наиболее часто в качестве донора H2S используют NaHS и натрия сульфид (Na2S). Однако при растворении этих молекул происходит слишком быстрое высвобождение H2S, что в условиях in vivo вызывает резкое снижение артериального давления, вплоть до сосудистого коллапса [1]. Процесс высвобождения H2S в этом случае трудно поддается контролю, что делает NaHS и Na2S непригодными для использования в терапевтических целях.
Другим направлением в разработках «сероводородных» препаратов является встраивание H2S-высвобождающих группировок в уже имеющиеся и широко используемые лекарственные молекулы. Альтернативные доноры H2S могут быть получены путем добавления сульфидных групп к нестероидным противовоспалительным препаратам. Например, S-диклофенак содержит тионовые группы, прикрепленные эфирными связями к молекуле-носителю, которые в растворе играют роль источника H2S [7]. Встраивание тиоловых группировок в молекулу силденафила приводит к развитию эффекта, связанного с выраженной релаксацией гладкомышечных клеток кавернозных тел [6]. Существующие ныне наработки в области создания доноров H2S, пригодных для использования в терапевтических целях, находятся на ранней стадии своего развития и явно недостаточны. Разработка, синтез и описание свойств новых доноров H2S и селективных ингибиторов ферментов его эндогенного синтеза имеют чрезвычайно важное значение для создания новых лекарственных препаратов [8].
Читайте также: Дисфункция эндотелия: профилактика прежде всего!
Таким образом, следует полагать, что молекула H2S еще не раскрыла ученым всех своих «секретов», и дальнейшие исследования в этом направлении безусловно позволят достичь новых успехов в борьбе с сердечно-сосудистыми заболеваниями.
Подготовил Руслан Примак, канд. хим. наук
“Фармацевт Практик” #11′ 2018