ORANGE BOOK: у практиці лікаря і фармацевта
Управління з контролю якості харчових продуктів і лікарських препаратів США (FDA) щомісяця оновлює і публікує перелік зареєстрованих лікарських засобів з оцінкою їхньої терапевтичної еквівалентності, а щорічно видає повну версію цього широко відомого документа під назвою Orange Book. Критеріями включення будь-якого препарату до Переліку є наявність заявки на реєстрацію і дані про підтвердження безпеки та ефективності лікарських засобів згідно з Федеральним законом про харчові продукти, лікарські засоби і парфумерно-косметичні вироби. До Переліку не входять ті ліки, що мають лише дані про підтвердження безпеки або належать до препаратів, випущених на ринок до 1938 р. (наприклад, фенобарбітал). Усі зареєстровані генеричні та комбіновані лікарські засоби мають код еквівалентності. Наведені оцінки є загальнодоступною інформацією і використовуються як рекомендації для органів охорони здоров’я, лікарів, які призначають препарати, і працівників аптек. Розповідає Ганна Зайченко, д-р мед. наук, професор, член Європейської асоціації клінічної фармакології та терапії (EACPT), член Міжнародного союзу фундаментальної та клінічної фармакології (IUPHAR), завідувачка кафедри фармакології НМУ ім. О.О. Богомольця
Навіщо потрібен Orange Book?
Відомо, що жодна система охорони здоров’я не здатна задовольнити всі потреби суспільства, навіть у таких багатих і розвинених суспільствах, як США. З метою зменшення витрат на систему охорони здоров’я практично всі північноамериканські штати прийняли відповідні постанови, які заохочують генеричну заміну лікарських засобів. За цими наказами заміна може обмежуватись лише препаратами, які входять до певного переліку (позитивний формулярний підхід), або, навпаки, будь-яким лікарськими засобами, за винятком тих, що входять до певного переліку (негативний формулярний підхід). Але через велику кількість звернень по допомогу при підготовці формулярів до FDA наприкінці 70-х років минулого століття стало зрозуміло, що задовольнити потреби кожного штату організація не зможе. Тому було визнано доцільним складання єдиного переліку.
31 травня 1978 р. FDA заявило про намір скласти перелік усіх зареєстрованих рецептурних лікарських засобів із підтвердженою безпекою та ефективністю із зазначенням їхньої терапевтичної еквівалентності. Перший його варіант був запропонований у грудні 1979 р.
Наразі ORANGE BOOK є авторитетним довідником, джерелом інформації про безпечні та ефективні лікарські засоби, схвалені FDA, з оцінкою їхньої терапевтичної еквівалентності препарату порівняння. Наявність в цьому довіднику торгової марки виробника є гарантією якості лікарського засобу і відповідності прийнятим в США і Європі стандартам.
Яка інформація міститься в Orange Book?
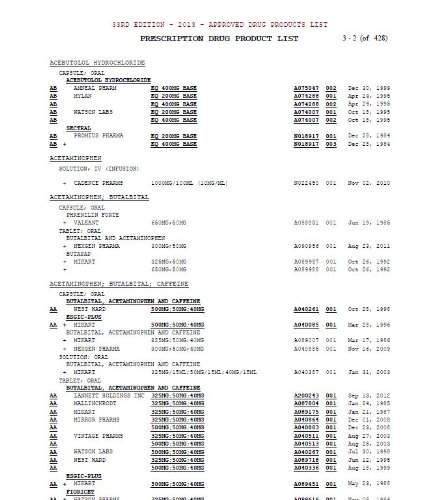
У довідник включені алфавітні покажчики рецептурних і безрецептурних лікарських засобів за торговими або прийнятими назвами (якщо торгова назва відсутня) і компаній-заявників (власників реєстраційного посвідчення). Всі прийняті назви діючих речовин зазвичай збігаються з офіційними фармакопейними назвами лікарських засобів відповідно до «Довідника національних непатентованих назв США».
Сам Перелік лікарських засобів складається з чотирьох частин.
- Зареєстровані рецептурні лікарські засоби з оцінкою їхньої терапевтичної еквівалентності.
- Зареєстровані безрецептурні лікарські засоби на основі фармацевтичних субстанцій, які не допускаються до реалізації без реєстрації.
- Лікарські засоби, зареєстровані відповідно до розділу 505 Федерального закону про харчові продукти, лікарські засоби і парфумерно-косметичні вироби, якими опікується Центр експертизи і вивчення біологічних препаратів FDA.
- Зведений поповнюваний перелік зареєстрованих препаратів, які:
- ніколи не вводилися в обіг;
- призначені для експорту;
- мають військове призначення;
- виведені з обігу;
- реєстрація на які припинена з причин, не пов’язаних з питаннями безпеки або ефективності.
До Переліку не включені деякі препарати великого обсягу в скляних флаконах для внутрішньовенного введення, які широко застосовуються (наприклад, 5% і 10% розчини глюкози для ін’єкцій; 0,9% розчин натрію хлориду), оскільки вони знаходяться в обігу без ухвалення FDA.
Що таке еквівалентність ліків?
Говорячи про еквівалентність необхідно зазначити, про яку йде мова — фармацевтичну, біологічну чи терапевтичну.
Лікарські засоби визнають фармацевтично еквівалентними, якщо вони мають однакову (-вий):
- діючу речовину;
- лікарську форму;
- спосіб введення;
- дозу (містять однакову кількість діючої речовини) або концентрацію.
Однак такі препарати можуть відрізнятися за зовнішньою формою, конфігурацією розділових борозенок на лікарській формі, механізмом вивільнення, упаковкою, допоміжними речовинами (зокрема фарбниками, ароматизаторами, консервантами), терміном придатності та, певною мірою, маркуванням.
Якщо відмінності в конфігурації упаковки лікарських засобів мають терапевтичне значення, такі препарати не визнають фармацевтичними еквівалентами. Наприклад, деякі пероральні контрацептиви фасують в упаковки по 21 або по 28 таблеток. В упаковці з 28 таблетками 7 — це плацебо або солі заліза. Ці дві конфігурації упаковки не вважають фармацевтично еквівалентними.
Лікарські засоби визнають фармацевтично альтернативними, якщо вони містять однакову активну частину молекули діючої речовини, але у вигляді різних солей, складних ефірів або сполук, мають різні лікарські форми або дозу (наприклад, тетрацикліну гідрохлорид, капс. 250 мг та комплекс тетрацикліну з фосфатами, капс. 250 мг або хінідину сульфат, табл. по 200 мг та хінідину сульфат, капс. по 200 мг). Фармацевтично альтернативними є також різні лікарські форми і дози в межах лінійки одного продукту від одного виробника, препарати з уповільненим вивільненням порівняно із засобами з негайним або стандартним вивільненням однієї діючої речовини.
Термін «біологічна еквівалентність» лікарських засобів застосовують для фармацевтичних еквівалентів або фармацевтичних альтернатив, які демонструють порівняну біодоступність при дослідженні в однакових експериментальних умовах. Відмінності у вмісті консервантів та допоміжних речовин не впливають на оцінку фахівцями FDA терапевтичної еквівалентності за умови, якщо вони не чинять вплив на біоеквівалентність чи спосіб введення.
Як стандартний зразок для порівняння біоеквівалентності, який повинні демонструвати всі препарати-генерики, зазвичай визначають тільки один зареєстрований препарат. У такий спосіб прагнуть уникнути можливих значних відмінностей між непатентованими (генеричними) ліками і їхнім брендовим еквівалентом.
FDA визначає терапевтично еквівалентними лікарські засоби, якщо вони відповідають таким загальним критеріям.
- Зареєстровані як безпечні та ефективні.
- Фармацевтично еквівалентні, оскільки:
- містять однакову кількість тієї самої діючої речовини;
- мають однакову лікарську форму;
- мають однаковий спосіб введення;
- відповідають фармакопейним або іншим стандартам, які застосовують, щодо дозування, якості, чистоти або дійсності.
- Біоеквівалентні, оскільки:
- не становлять ніякої відомої або передбачуваної проблеми біонееквівалентності, а також відповідають прийнятному стандарту in vitro;
- якщо і становлять відому або можливу проблему, то демонструють відповідність прийнятному стандарту біоеквівалентності.
- Мають належне маркування.
- Виготовлені відповідно до вимог GMP.
Концепція терапевтичної еквівалентності, на основі якої розробляли Перелік, не передбачає порівняння різних препаратів, які використовують у терапії однакових патологічних станів (наприклад, меперидину гідрохлорид або морфіну сульфат для лікування больового синдрому). Будь-який лікарський засіб із цього Переліку, що повторно перепаковує і/або поширює не заявник, вважають терапевтично еквівалентним лікарському засобу заявника. А от визначення терапевтичної еквівалентності не поширюється на його застосування не за показаннями, зазначеними в інструкції.
На думку експертів FDA визнані терапевтично еквівалентними лікарські засоби є повністю взаємозамінюваними через те, що вони здатні забезпечити клінічний ефект і профіль безпеки.
За яким принципом кодують лікарських засобів?
Мета Orange Book — підвищити обізнаність передовсім професійної спільноти щодо вибору лікарських препаратів. Для оптимізації роботи користувача застосовують кодування оцінки терапевтичної еквівалентності лікарських засобів. Дві основні категорії, за якими розподіляють генерики, позначені першими буквами алфавіту — «А» і «В».
Лікарський засіб з кодом «А» FDA вважає терапевтично еквівалентними іншим фармацевтично еквівалентним препаратам. Що це означає?
- Відсутні відомі або підозрювані проблеми із біоеквівалентністю. Такі лікарські засоби позначають кодами AA, AN, AO, AP чи AT. Друга буква коду вказує на лікарську форму препарату.
- Існуючі або можливі проблеми із біоеквівалентністю були вирішені, що підтверджено шляхом додаткових досліджень, проведених in vivo та/або in vitro. Такі препарати позначають кодом AB.
Кодом «B» позначають:
- Готові лікарські засоби, діючі речовини або лікарські форми яких мають документально підтверджені або потенційні проблеми з біоеквівалентністю, щодо яких FDA не отримало результатів належних досліджень, які б продемонстрували факт усунення цих проблем. Зауважимо, що частіше дана проблема стосується певних готових лікарських форм, а не діючої речовини. Такі лікарські засоби позначають кодами BC, BD, BE, BN, BP, BR, BS, BT, BX або B*.
- Лікарські засоби, стандарти якості яких є неприйнятними або FDA не має достатньо підстав для визнання їхньої терапевтичної еквівалентності.
- Лікарські засоби, що знаходяться на регуляторному контролі.
Трисимвольні коди застосовують, якщо для порівняння наведено більше одного зареєстрованого препарату з однаковим дозуванням/ концентрацією. Два або більше зареєстрованих ліків беруть у разі невизнання щонайменше двох потенційних препаратів порівняння біоеквівалентними один одному. Препарати з трисимвольним кодом під одним заголовком вважають терапевтичними еквівалентами тільки іншим препаратам з тим самим трисимвольним кодом під тією самою назвою.
Щорічно оновлення інформації в Orange Book служить надійним помічником у практичній діяльності лікаря та фармацевта, допомагаючи їм у правильному виборі лікарських засобів для оптимізації ефективності та економічної обґрунтованості призначеної пацієнту терапії.
В Orange Book наведені також лікарські засоби, що потребують окремого обговорення. Наприклад, розчини для ін’єкцій амінокислот і білкових гідролізатів, які відрізняються за кількістю і видами амінокислот, що в них містяться, не вважають фармацевтично і відповідно терапевтичними еквівалентами. Однак FDA вказує, що у випадках, коли азотний баланс є єдиною терапевтичною метою, вміст будь-якої окремої амінокислоти не має особливого значення. Тож фармацевтично альтернативні лікарські засоби з однаковим сумарним вмістом азоту можна вважати терапевтично еквівалентними
Чи є актуальним Orange Book в Україні?
Для медичних працівників (лікарів і фармацевтів) вкрай важливо мати доступ до достовірної інформації про взаємозамінність лікарських засобів, яка в нашій країні, на жаль, практично відсутня. Це призводить до того, що під час вибору препарату фахівець послуговується суб’єктивними даними — маркетинговою активністю компаній-виробників або наявністю певних ліків. Зауважимо, що на українському фармацевтичному ринку 85% лікарських засобів є генериками і тільки 15% — оригінальними препаратами. Систематизована та своєчасно поновлювана інформація про лікарські засоби дозволяє підвищити якість лікування і безпеку фармакотерапії.
Існує український аналог Orange Book — «Rx index — Довідник еквівалентності лікарських засобів». Видання підготовлено колективом авторів за редакцією проф. Зупанця І.А. і академіка НАН України проф. Черних В.П. Структура довідника створена за АТС-класифікацією. Як і в Orange Book, тут можна знайти лікарські засоби за торговою та міжнародною непатентованою назвою українською та іноземною мовами. Це перший в Україні довідник, в якому представлено принципи доказової еквівалентності лікарських засобів для генериків, традиційних ліків і препаратів із добре вивченим медичним застосуванням. Класифікацію еквівалентності подано на основі методичних рекомендацій МОЗ України 77.17/119.17 «Теоретичне обґрунтування принципів оцінки еквівалентності лікарських засобів в Україні». Наразі готується 4-те видання довідника. «Rx index — Довідник еквівалентності лікарських засобів» — це перехід на якісно новий рівень можливостей для впровадження в практичну діяльність лікаря і фармацевта принципів доказової медицини.
Висловлюємо подяку у підготовці матеріалу Олені Труш
*Лікарські засоби, які потребують подальшого дослідження та огляду для визначення терапевтичної еквівалентності
“Фармацевт Практик” #2′ 2020