Почему “не работают” антибиотики?
В свое время Иван Павлов сказал: «Действуя на микробы, следует помнить об их интересах». Главный интерес микроба, впрочем, как и любого живого организма, – выжить. И он отстаивает его всеми доступными способами
Направление удара
Антибактериальный эффект антибиотиков – бактерицидный или бактериостатический – обусловлен их «вмешательством» в обменные процессы бактерий. Разница в том, что одни антибиотики непосредственно влияют на бактериальные ферменты, а другие действуют опосредованно, через структурные элементы бактериальных клеток.
Взять, к примеру, бета-лактамы. Представители бета-лактамного семейства, в частности пенициллины и цефалоспорины, действуют бактерицидно, вызывая разрушение (лизис) бактерий. Правда, бета-лактамы, ингибируя ферменты, ответственные за финальную стадию синтеза пептидогликанового каркаса, лишь запускают процесс уничтожения. Завершают же его собственные аутолизины бактерий. Призванные контролировать расщепление пептидогликанов при делении бактерий, в присутствии антибиотиков они – пока неясно почему – «забывают» о своем предназначении, что приводит к саморазрушению пептидогликанового каркаса и разрыву клеточной мембраны.
В отличие от бета-лактамов, макролиды, хлорамфеникол, линкомицин/клиндомицин не убивают бактерий, а лишь временно подавляют их способность к размножению. Да и действуют они иначе: связываясь с 50S-субъединицей рибосом, блокируют элонгацию (удлинение) пептидных цепей, тем самым препятствуя образованию полноценного белка.
Аминогликозиды и тетрациклины тоже взаимодействуют с рибосомами, вернее, с их 30S- субъединицей. И те и другие подавляют синтез белка на начальном этапе, но из-за разного характера взаимодействия с рибосомами эффекты проявляют разные: аминогликозиды – бактерицидный, тетрациклины – бактериостатический.
Самое любопытное, что порой антибиотики проявляют совершенно неожиданные свойства.
Как недавно выяснилось, у больных с рассеянным склерозом после 4-месячного курса лечения доксициклином значительно сокращается площадь пораженных участков головного мозга, по-видимому, благодаря способности антибиотика ингибировать ферменты, участвующие в разрушении миелиновой оболочки нервных волокон.
У пациентов с атеросклерозом, артритом и бронхиальной астмой после приема азитромицина, рокситромицина и кларитромицина заметно улучшается состояние. В этом случае эффективность препаратов объясняется их способностью корригировать «чрезмерные» воспалительные реакции, обусловленные полиморфноядерными нейтрофилами и моноцитами. Аргумент простой – высокое содержание вышеупомянутых макролидов в такого рода иммунных клетках.
Кстати сказать, с 90-х годов ХХ века ведется целенаправленный поиск низкомолекулярного вещества, обладающего одновременно и антибактериальной, и иммуномодулирующей активностью. Пока дело ограничивается одним препаратом – цефодизимом, который получен на основе цефалоспориновой структуры. Он действует на две мишени: бактерию и фагоцит и оказывает антибактериальное и иммуностимулирующее действие.
Читайте также: Досье на «великих и ужасных»: 12 вопросов об антибиотиках
Линия обороны
Резистентность бывает первичной и приобретенной.
Первичная резистентность имеет место до встречи с антибиотиком, является видовым признаком и кодируется в хромосомных генах бактериальных клеток, проявляясь «внешне» (в терминологии генетиков – фенотипически) непроницаемостью клеточной стенки или отсутствием мишени. К примеру, микоплазмы резистентны к бета-лактамам по причине отсутствия пептидогликанового каркаса; грамотрицательные бактерии (за исключением нейсерий) малочувствительны к природным пенициллинам из-за особенностей наружной мембраны, препятствующей проникновению препаратов; анаэробные бактерии нечувствительны к аминогликозидам из-за отсутствия транспортных систем, необходимых для ассимиляции такого рода антибиотиков.
Приобретенная (вторичная) резистентность непредсказуема. Бывает, что и по прошествии десятилетий препарат не утрачивает своей эффективности. Иллюстрация тому – спирамицин. Синтезированный более полувека назад, он до сих пор высокоактивен в отношении типичных возбудителей инфекций дыхательных путей, кожи и мягких тканей. Бывает, что устойчивость развивается в течение первых двух лет применения антибиотика или даже на стадии его клинических испытаний, как это произошло с ванкомицином, гентамицином, цефамандолом и ципрофлоксацином.
Словом, появится резистентность или нет, и если появится, то когда, спрогнозировать невозможно. Однако доказано, что возникновение устойчивости связано либо с хромосомными мутациями, либо с приобретением генов резистенстентности (r-генов), переносимых плазмидами и транспозонами.
Не вдаваясь в подробности, плазмиды можно охарактеризовать как внехромосомную ДНК, способную к самовоспроизведению. Транспозоны в норме представляют собой небольшие участки геномной (хромосомной) ДНК. Перед транспортировкой в бактерию-рецепиент они вырезаются из хромосомы и формируют кольцевую структуру. Попав к месту назначения, транспозон встраивается в геном нового хозяина.
Конъюгация бактерий – процесс, при котором происходит перенос генетической информации из одной бактерии в другую
Не исключено, что по распространенности и разнообразию транспозоны не уступают плазмидам, но это лишь предположение.
Гены резистентности обнаружены в изолятах из регионов, где никогда не использовался данный антибиотик, и в штаммах, законсервированных задолго до наступления «эры антибиотиков», правда, в единичных бактериях, точнее, клонах.
Удивляться, в общем-то, нечему, и в том и в другом случае никаких преимуществ r-гены своим владельцам не создают. Очевидные преимущества у резистентных клонов появляются лишь в присутствии антибиотика: они выживают, формируют устойчивую популяцию, а иногда – устойчивый вид, как в случае пенициллиноустойчивых стафилококков.
Читайте также: Как вернуть антибиотикам их «чудесную» силу?
Удивительно другое, оказывается, патогенные бактерии – не единственный источник генов резистентности. Как утверждают некоторые исследователи, в роли источников r-генов могут выступать и непатогенные бактерии, находящиеся в пище. Гены резистентности были обнаружены во многих продуктах, готовых к употреблению (мясе, морепродуктах и др.). К тому же удалось доказать, что комменсалы* «могут увеличивать их (r-генов) количество и усиливать резистентность к антибиотикам».
Претендуют на роль источников r-генов и сами антибиотики.
Дело в том, что в препаратах природного происхождения в виде примесиприсутствует генетический материал их продуцентов. Вполне возможно, что в этой примеси содержатся гены устойчивости к продуктам собственного производства – антибиотикам. При пероральном приеме препарата ДНК продуцента непосредственно контактирует с кишечной микрофлорой, в результате чего некоторые ее представители становятся обладателями генов резистентности.
Так это или не так, однозначно сказать нельзя, зато известно, что в реализации резистентности задействованы такие биохимические механизмы, как:
– инактивация антибиотика;
– модификация клеточной мишени;
– уменьшение проницаемости внешних структур бактериальных клеток;
– формирование новых метаболических путей;
– активное выведения антибиотика из бактериальной клетки.
Так, в борьбе с бета-лактамами бактерии изредка «идут» на ферментативную модификацию мишени – пенициллинсвязывающих белков. Иногда синтезируют дополнительный пенициллинсвязывающий белок, тем самым формируя новый метаболический путь, неуязвимый для антибиотика. Чаще разрушают антибиотики с помощью бета-лактамаз.
В противостоянии с аминогликозидами основным «оружием» тоже является инактивация антимикробного агента, только действует это «оружие» иначе: ферменты модифицируют молекулы аминогликозидов таким образом, что они утрачивают способность связываться с бактериальными рибосомами и подавлять синтез белка.
Некоторые грамотрицательные бактерии успешно «обороняются» от антибиотиков, сокращая – полностью или частично – продукцию поринов. (Иначе говоря, белков, которые формируют каналы во внешней мембране.) Полная или частичная утрата каналообразующих белков уменьшает проницаемость мембраны для антибиотиков, причем не одного, а сразу нескольких семейств.
Некоторые грамотрицательные бактерии в борьбе с антибиотиками используют системы активного выброса ксенобитиоков, именуемые «помпами» и состоящими как минимум из трех специфических белков:
– белка-транспортера, который распознает ксенобиотик на стадии проникновения в цитоплазматическую мембрану и «выбрасывает» его в периплазматическое пространство (в пространство между цитоплазматической мембраной и пептидогликановым каркасом);
– белка-каналообразователя, пронизывающего внешнюю мембрану и «выбрасывающего» ксенобиотик из бактериальной клетки;
– белка-линкера, расположенного в периплазматическом пространстве и связывающего белок-транспортер с белком-каналообразователем.
Объективности ради надо сказать, что этот вид «оружия» плохо изучен.
Есть сведения, что большинство помп, имея «широкую специализацию», способны удалять из бактериальной клетки несколько совершенно разных препаратов, таких, например, как тетрациклины, хлорамфеникол (левомицетин) и эритромицин. Помпы с «узкой специализацией», которых гораздо меньше, бактерии используют для выведения карбенициллина. Правда, непонятно каким образом, мишень-то находится на наружной стороне цитоплазматической мембраны, а чтобы «выбросить» антибиотик, белок-транспортер должен его сначала распознать на стадии проникновения в эту мембрану.
И еще. Вопреки бытующему мнению, приобретенная устойчивость сохраняется и в отсутствие антибиотиков. Чтобы поддерживать ее, бактерии до поры до времени вынуждены «платить» меньшей приспособленностью к окружающей среде, замедленной скоростью роста и возросшей (из-за синтеза дополнительных белков и нуклеиновых кислот) метаболической нагрузкой. Освободиться от «метаболической дани» удается лишь отдаленным потомкам.
Возьмем для примера стрептомициноустойчивый штамм кишечной палочки.
Первые 180 (!) поколений резистентного штамма уступали своим «диким» сородичам в скорости как минимум на 14%. Следующее поколение, появившееся опять-таки в отсутствие антибиотика, «платило» гораздо меньше. В конце концов резистентный штамм освободился от «дани». Мало того, потребность в ресурсах у него стала гораздо меньше, чем у диких штаммов. И все потому, что у резистентных потомков кишечной палочки «включился» компенсаторный механизм – произошли новые геномные мутации.
В общем, отдаленным потомкам приобретенная резистентность явно пошла на пользу. Даже в отсутствие антибиотика.
Читайте также: Борьба с устойчивостью к противомикробным средствам: роль провизоров и фармацевтов
*Комменсал – организм, живущий в тесной взаимосвязи с другими, отличающимися от него организмами, не причиняя им ни вреда, ни пользы. Например, некоторые микроорганизмы, живущие в кишечнике человека, получают из него пищу, не оказывая на человека никакого влияния. Кишечник является для них подходящей средой обитания
Ламара Львова, канд. биол. наук
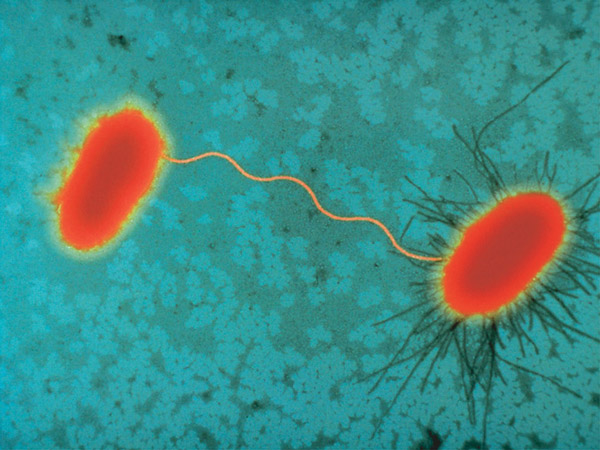
На фото рядом с заголовком: кишечная палочка (Escheriсhia coli); сканирующая электронная микроскопия
“Фармацевт Практик”
