Создание новых лекарств: эксперимент in silico
Успехи применения компьютерных технологий вместе с существованием большого количества баз данных, касающихся последовательности ДНК, структуры белков, сложных молекул органических веществ, фенотипические описания тысяч организмов и многих других биологических, биофизических, биохимических сведений привели к «перевороту» в биологии: теперь ученые могут совершать открытия и даже конструировать новые лекарства, ни разу не прикоснувшись к пипетке и не проведя ни одного лабораторного эксперимента. Такой подход стал возможен благодаря новой науке — биоинформатике
Наука или метод исследования?
Биология не раз переживала новое рождение: сначала она была «полевой» наукой, изучавшей животных и растения, а главными орудиями биологов были сачок и лупа; в XX в. она переместилась в лаборатории, концентрируясь на молекулярных основах жизни и наследственности, где инструментами исследования стали микроскоп и пробирки. Наконец в XXI в. история двинулась дальше — многие эксперименты теперь проводятся на компьютере, а материалом для изучения являются последовательности белков и ДНК, информация о строении биологических молекул и т.д. Такое направление получило свое название — «биоинформатика».
Возникает вопрос: является ли биоинформатика наукой или методом исследования? Следует полагать, что это и наука, и метод, и стратегия исследования. Метод — если рассматривать биоинформатику как набор технологий, позволяющий работать с огромным массивом данных и получать с их помощью новые результаты. Научная сторона биоинформатики связана с развитием информационной биологии. Как любая наука, она имеет собственные задачи и занимается изучением механизмов хранения, передачи и реализации биологической информации на разных уровнях. Таких уровней несколько: геном, клетка, взаимодействие между клетками, организм, популяция в целом. Биоинформатика возникла на стыке наук — молекулярной биологии, генетики, физиологии, математики, информатики, физики и химии, а такого рода объединения имеют стратегический характер. Самые крупные достижения возможны тогда, когда происходит синтез наук. Биология и информатика — классическое отражение этой ситуации.
Читайте также: Рождение лекарства: доклинические исследования
Непростые задачи биоинформатики
Основная задача биоинформатики как науки — разработка вычислительных алгоритмов для анализа и систематизации данных о структуре и функциях биологических молекул, прежде всего нуклеиновых кислот и белков. Объем генетической информации, накапливаемой в банке данных, начал увеличиваться с возрастающей скоростью после разработки быстрых методов секвенирования (расшифровки нуклеотидных последовательностей ДНК). Методы биоинформатики позволяют не просто обрабатывать этот огромный массив данных, но и выявлять закономерности, которые не всегда можно заметить при обычном эксперименте, предсказывать функции генов и зашифрованных в них белков, строить модели взаимодействия генов в клетке, а также конструировать лекарства.
In silico – современный термин
Для обозначения всего, что связано с компьютерными экспериментами, в 90-е годы XX в. возник новый полушутливый термин — in silico (от лат. «in silicon», т.е. «в кремнии», поскольку кремний как полупроводниковый материал играет важную роль в производстве компьютерного оборудования), который дополнил ряд уже имеющихся еще с конца позапрошлого столетия классических определений характера экспериментальной среды — in vivo («вживую», т.е. непосредственно в биологической системе) и in vitro («в стекле», т.е. в искусственно созданной среде — в пробирке). Термины in vivo и in vitro хорошо прижились среди экспериментаторов, однако, смысл их использования достаточно относителен. Так, под in vivo молекулярный биолог, изучающий аспекты синтеза белка, может подразумевать колонию искусственно выращенных клеток, а под in vitro — систему бесклеточного синтеза в пробирке. При этом для физиолога, изучающего механизмы проведения нервного импульса, in vivo — это целый организм, а in vitro — культура нервной ткани. В свою очередь, подход in silico также многоуровневый и включает в себя задачи по моделированию поведения отдельных молекул, биохимических процессов и даже функционированию отдельных физиологических систем.
Читайте также: Дорога в будущее: от нуклеотида к лекарству
Рациональный драг-дизайн
Как отмечалось выше, одной из возможностей биоинформатики и, соответственно, экспериментов in silico является создание новых лекарств.
Потребность в создании более эффективных лекарств существует при лечении многих заболеваний. Однако путь молекулы-кандидата на фармацевтический рынок может длиться десятки лет, а стоимость создания нового оригинального лекарства составляет в наше время несколько миллиардов долларов, поэтому интенсивный поиск новых путей решения этой проблемы является весьма актуальным.
Большинство веществ, а также их смесей, которые легко получить из природных источников, например, выделив экстракт из листьев или корней какого-либо растения, уже давно исследованы на наличие биологической активности и, соответственно, на пригодность использования в качестве лекарств. Поэтому ныне лекарства часто «изобретают» на компьютере, а потом уже проверяют в лаборатории. Рациональное конструирование лекарств, или «драг-дизайн», это активно развивающаяся в последнее время область исследований.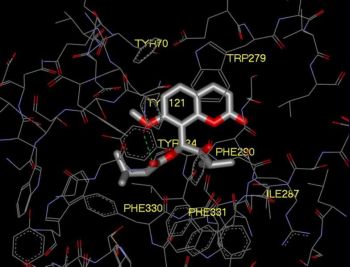
Базы данных (например, PubChem, ChEMBL, ZINC) содержат десятки миллионов химических соединений. Проверить экспериментально — является ли каждая молекула лекарством от какой-либо болезни — практически невыполнимая задача. Именно поэтому необходимо проводить первичный отбор в этом огромном множестве химических соединений in silico, основываясь на их структуре и известных свойствах. Для этого существует несколько различных подходов. Одним из них является молекулярный докинг — метод молекулярного моделирования, который позволяет предсказывать наилучшее положение лиганда (обычно малой молекулы) относительно белка-мишени, используя их трехмерные структуры и оценочные функции энергии взаимодействия молекул. Другой метод — молекулярная динамика, которая основана на использовании уравнений движения атомов и эмпирических функций потенциальной энергии для расчетов межатомных взаимодействий и описания эволюции молекулярной системы во времени.
Читайте также: Новые парадигмы классической фармакотерапии
Прекрасным примером успешного использования такого подхода может служить ингибитор фермента тирозинкиназы иматиниб (противолейкозный препарат). Он был разработан с помощью метода рационального драг-дизайна — скрининга библиотек химических соединений для поиска вещества, ингибирующего определенный белок-мишень. Этот препарат является «таргетным», т.е. направленным — губительно действующим только на энзим злокачественных клеток. Его изобретатели в 2009 г. получили премию Ласкера (которую иногда называют американской Нобелевской премией) и в 2012 г. — премию Японии.
«Подводные камни» компьютерного моделирования
Следует отметить, что далеко не всегда лучшие по результатам компьютерного моделирования, т.е. in silico, молекулы — «кандидаты» в лекарства — становятся впоследствии новым препаратом. Причинами этого могут быть, например, недостаточная растворимость, стерические (пространственные) ограничения при связывании с молекулой-мишенью (обычно белком) и т.д. Однако среди таких «подводных камней» не исключены и другие веские причины, в частности, защита опережающим патентом.
Отбраковка потенциального лекарства не исключена даже на стадии клинических испытаний, например, из-за проблем с доставкой к пораженным тканям и органам. Оно может слишком быстро разрушаться и выводиться из организма, так и не достигнув цели. Кросс-реактивность — еще одна проблема при создании лекарственных средств. Она заключается в том, что молекулы потенциального лекарства часто могут взаимодействовать не только с предполагаемой нами мишенью, но и с другими белками в организме. В таком случае побочные эффекты могут быть даже более опасны, чем сама болезнь.
Читайте также: Стволовые клетки: правда и вымыслы
Поэтому при создании лекарств в in silico-эксперименте для повышения эффективности этого метода необходимо прежде всего понять молекулярные основы той болезни, для которой данный препарат предназначен. Кроме того, следует изучить причины и установить основные взаимодействия между белками. Таким образом, в принципе можно описать развитие заболевания на молекулярном уровне с помощью каскада реакций. Это необходимо для определения, какие белки являются наиболее перспективными мишенями (объектами, на которые нужно воздействовать, чтобы исправить или компенсировать нарушения, играющих важную роль в его патогенезе).
Вместо заключения
Несмотря на огромный объем проделанной работы, полагают, что in silico-эксперимент находится все еще на начальной стадии развития, однако, уже стал существенным подспорьем для «обычного» эксперимента, позволяя формулировать новые гипотезы и выявлять возможные механизмы молекулярных процессов, протекающих внутри живой клетки. Насколько стремительно будет развиваться эта область — покажет будущее, но уже сейчас можно с уверенностью сказать, что имитация жизненных процессов на уровне молекул, выполняемая с помощью компьютерной техники, прочно заняла свое место в науках о жизни, гармонично дополняя лабораторные эксперименты. Аналогичным образом около ста лет назад опыты in vitro, ставшие в настоящее время рутинными, «потеснили» исследования на животных. Таким образом, можно считать, что новый виток в развитии науки начинается уже сегодня.
Подготовил Руслан Примак,
канд. хим. наук
“Фармацевт Практик” #10′ 2015

