Апелін: багатовекторність «дивного» пептиду
Протягом останніх двох десятиліть пильну увагу хіміків та фармакологів привертають молекулярні механізми, що лежать в основі фізіологічних процесів, регуляція яких здійснюється апелінергічною системою. Пояснюється це тим, що детальне вивчення даних механізмів може сприяти появі нових лікарських засобів, спроможних більш ефективно лікувати різні патології, й перш за все серцево-судинні захворювання
У пошуках активаторів нового рецептора
Ще у 1993 р. відбулося відкриття рецепторного білка, який отримав назву APJ й був дуже схожим на рецептор ангіотензину. Обидва ці рецептори були мембранними білками, а їхні трансмембранні домени співпадали на 40–50%. За структурою APJ належить до великого сімейства трансмембранних рецепторів, спряжених з G-білками (англ. Guanine nucleotide-binding proteins), що зв’язують гуанілові нуклеотиди й беруть участь у клітинній сигналізації еукаріот. За допомогою цих рецепторів організм реагує на багато зовнішніх сигналів, таких як світло, звук, запах тощо. Але, всупереч очікуванню дослідників, новий рецептор APJ, хоча й був подібним до рецептора ангіотензину, але саме ангіотензин зв’язувати «відмовлявся» [1].
Пошуки зовнішнього сигналу, котрий активував би рецептор APJ, привели у 1998 р. до відкриття пептиду, що отримав назву «апелін» [1]. Як з’ясувалося дещо пізніше, з ангіотензином ІІ його споріднює те, що обидва ці пептиди є субстратами ангіотензинперетворювального ферменту (АПФ2), котрий їх руйнує.
Надзвичайно важлива вісь
Оскільки апелін секретується жировими клітинами (адипоцитами), іноді вважають, що він належить до гормонів жирової тканини — адипокінів. Однак найвищий рівень його синтезу відбувається в ЦНС, особливо в таламусі та лобній корі головного мозку, а також у спинному мозку та гіпофізі.
З моменту відкриття цього пептиду вчені виявили його надзвичайну багатогранність. Рецептори APJ є практично в усіх органах і тканинах. Найбільша їх кількість спостерігається в легенях, серці, скелетних м’язах, а також у нирках, кишечнику, надниркових залозах та у стінках кровоносних судин. Це пов’язано з тим, що APJ і апелін беруть участь у роботі гіпоталамо-гіпофізарно-надниркової осі, котра відіграє центральну роль у гомеостазі, водно-сольовому обміні й діяльності серцево-судинної, імунної, репродуктивної та нервової систем. Ця вісь одночасно інтегрує контроль функцій нервової та ендокринної систем, що дозволяє їм спільно реагувати на фізичні та психосоціальні зовнішні впливи. Тобто вона дає можливість організму ефективно адаптуватися до довкілля, використати ресурси й оптимізувати виживання. До речі, підтвердженням надзвичайної важливості й складності дослідження рецепторів, спряжених з G-білками, є той факт, що американські вчені Роберт Лефковіц та Браян Кобилка у 2012 р. одержали Нобелівську премію з хімії за вивчення просторової структури цих рецепторів.
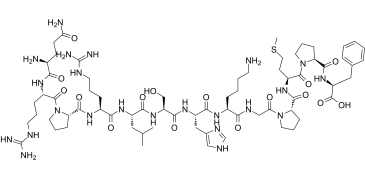
Апелін-13
Послідовність ДНК, що кодує 77 амінокислотних залишків препропептиду групи апеліну — ендогенних лігандів APJ, а також самі пептиди, які містять С-кінцеві фрагменти різного розміру, виявлено в тканинах різних тварин, а також людини. При дослідженні мРНК апеліну було встановлено, що існує ціле сімейство пептидів з різною молекулярною масою, які специфічно активують рецептори APJ [2]. Дані нещодавно проведених досліджень свідчать про те, що більш висока біологічна активність у цьому сімействі притаманна пептидам, які містять 17, 13 та 12 амінокислотних залишків. Найактивнішим з них виявився (PyrI) апелін-13.
Нова терапевтична мішень?
Ацильовані аналоги апелін-13-аміду виявилися стійкими до деградації ферментами. Їх випробовували як препарати, що можуть перешкоджати ожирінню, пригнічуючи відчуття голоду, й розвитку цукрового діабету (ЦД), сприяючи секреції інсуліну й стимулюючи інсуліннезалежне поглинання глюкози клітинами. У експерименті на мишах, яких утримували на дієті з високим вмістом жиру, було встановлено, що тривале застосування ацильованих аналогів апелін-13-аміду сприяє розвитку протидіабетичного ефекту й покращує ліпідний профіль. При цьому підвищувалися толерантність до глюкози, секреція інсуліну та загального жиру в організмі [3]. Ці та деякі інші результати досліджень дозволяють розглядати апелінергічну систему як нову терапевтичну мішень при лікуванні ЦД та його ускладнень, а сам апелін вважати перспективним у пошуку нових методів лікування ЦД 2-го типу, інсулінорезистентності та метаболічного синдрому [4].
Залежно від конкретної потреби організму
Регуляторна роль рецепторної системи апелін/APJ у серцево-судинній (пато)фізіології робить її потенційним об’єктом досліджень, спрямованих на розробку нових ліків для лікування хворих із серцевою недостатністю та легеневою гіпертензією.
На відміну від ангіотензину, який спричиняє вазоконстрикцію (звуження судин) й підвищення артеріального тиску, апелін при системному введенні, навпаки, розслаблює периферійні судини й знижує артеріальний тиск [5]. При цьому на судини головного мозку він впливає протилежно — перешкоджає релаксації церебральних артерій, інгібуючи кальційзалежні калієві канали.
Така унікальна властивість апелінів підкреслює їхню значущість як терапевтичного агента, здатного одночасно підтримувати серцеву функцію й захищати серце від гіпертрофії та розвитку серцевої недостатності, й усе це — залежно від конкретної потреби організму. Результати низки досліджень продемонстрували, що апелін чинить стійку захисну дію проти інфаркту міокарда [6].
З моменту відкриття апеліну його активно досліджують у пацієнтів як з гіпертонічною хворобою, так і з ЦД 2-го типу, але даних про його значення в прогресуванні ураження серцево-судинної системи при поєднанні цих захворювань вкрай мало.
Можливий геропротектор?
Нещодавно в експериментальних дослідженнях було виявлено, що рівень компонентів сигнального шляху апелін/APJ з віком зменшуються, що прискорює початок, а також прогресування старіння [7]. У мишей з генетично обумовленим дефіцитом рецептора апеліну або самого апеліну вчені відзначали прискорене старіння серцево-судинної, сечової та репродуктивної систем. При цьому відновлення рівня апеліну збільшувало тривалість і покращувало якість життя у перестарілих тварин. Інфузії апеліну зумовлювали у них підвищення бадьорості та рухомості.
Дещо несподіваним, але досить цікавим напрямом досліджень дії апеліну на організм є його здатність боротися з саркопенією — віковими дегенеративними змінами скелетних м’язів. Цей пептид значно покращує функціонування м’язів за рахунок активації утворення нових мітохондрій, а також посилення здатності м’язів до регенерації, впливаючи на м’язові стовбурові клітини. У перспективі це, можливо, дозволить розробити фармакологічну стратегію попередження слабкості м’язів, що виникає з віком, та відновлення фізичного стану людей похилого віку [8], тобто апелін можна розглядати як потенційний кандидат у геропротектори.
Дослідження тривають
Згідно з вищевикладеним з апеліном пов’язано надзвичайно широке коло перспективних напрямів фармакологічних досліджень з метою створення нових ліків, що впливають на організм через апелінергічну систему, але прогнозувати результати цих експериментів занадто рано. Перш за все молекулярні механізми, що лежать в основі фізіологічних процесів, які регулюються цією системою, вивчено недостатньо. Крім того, на дослідників даного напрямку напевно чекатимуть багато нових проблем, які теж треба буде вирішувати. Так, наприклад, у нещодавно опублікованому огляді [9] наведено дані про те, що апелін може спричиняти розвиток атеросклерозу, стимулюючи оксидантний стрес, й посилювати артеріальну гіпертензію.
Зрозуміло, що цей «дивний» пептид становить величезний інтерес і для фундаментальної науки, тому всебічні дослідження його властивостей тривають. Отже, у найближчому майбутньому ми, певно, зможемо отримати відповідь на питання щодо поповнення арсеналу лікарських засобів для фармакотерапії якоїсь із розглянутих вище, а можливо, й інших патологій.
Підготував Руслан Примак,
канд. хім. наук
Література
- Kazuhiko Tatemoto, Masaki Hosoya, Yugo Habata et al. Isolation and Characterization of a Novel Endogenous Peptide Ligand for the Human APJ Receptor // Biochemical and Biophysical Research Communications. – 1998. – Vol. 251. – P. 471-476.
- Kawamata Y., Fukusumi S., Hosoya M. et al. Molecular properties of apelin: tissue distribution and receptor binding // Biochim. Biophis. Acta. – 2001. – Vol. 1538, № 2–3. – Р. 162-171.
- Parthsarathy V., Hogg C., Flatt P.R. et al. Beneficial long-term antidiabetic actions of N- and C-terminally modified analogues of apelin-13 in diet-induced obese diabetic mice // Diabetes Obes. Metab. – 2018. – Vol. 20. – P. 319-327.
- Castan-laurell I., Dray C., Knauf C. Apelin, a promising target for type 2 diabetes treatment? // Trends in Endocrinology & Metabolism. – 2012. – Vol. 23 (5). – P. 234-241.
- Mughal A., O’Rourke S.T. Vascular effects of apelin: Mechanisms and therapeutic potential // Pharmacology & Therapeutics. – 2018. – Vol. 190. – P. 139-147.
- Folino A., Accomasso L., Giachino C. et al. Apelin-induced cardioprotection against ischaemia/reperfusion injury: roles of epidermal growth factor and Src // Acta Physiol. – 2018. – Vol. 222. – e12924.
- Rai R., Ghosh A.K., Eren M. et al. Downregulation of the Apelinergic Axis Accelerates Aging, whereas Its Systemic Restoration Improves the Mammalian Healthspan // Cell Reports. – 2017. – Vol. 21. – P. 1471-1480.
- Vinel C., Lukjanenko L., Batut A. et al. The exerkineapelin reverses age-associated sarcopenia // Nat. Med. – 2018. – Vol. 24. – P. 1360-1371.
- Qun Zhou, Jiangang Cao, Linxi Chen. Apelin/APJ system: A novel therapeutic target for oxidative stress-related inflammatory diseases (Review) // International Journal of Molecular Medicine. – 2016. – Vol. 37. – P. 1159-1169.
“Фармацевт Практик” #2′ 2020



