Чотири головних питання щодо паркінсонізму
Минуло 200 років з того часу, як Джеймс Паркінсон описав хворобу, яка згодом отримала його ім’я. Розуміння патогенезу та лікування захворювання змінювалось, але й до сьогодні дослідники так і не знають, як її вилікувати. Ми вирішили познайомити читачів із сучасними уявленнями про дану проблему і завітали до лабораторії хімічної біології в Інституті органічної хімії і біохімії Академії наук Чеської Республіки. Тут у Празі працює група українських вчених, серед яких і Володимир Швадчак, робота якого з вивчення синуклеїну — ключового білка в патогенезі хвороби Паркінсона — була відзначена премією Отто Віхтерле за 2018 р.
Питання перше: як починається хвороба Паркінсона?

Володимир Швадчак
Пошкодження нейронів може тривати до двох десятиліть до появи симптомів паркінсонізму. Але на той час захворювання вже буде розвиватися необоротно. Відомо, що різноманітні симптоми, включаючи порушення сну, втрату нюху та закрепи, виникають задовго до появи моторних розладів.
Поки вчені не можуть визначити, у кого з осіб із такими симптомами розвинеться паркінсонізм. Наразі дослідники шукають біомаркери хвороби у крові та сечі або кореляції із зображенням тканин мозку, що можуть об’єктивно визначити ризик розвитку паркінсонізму. Але до цього часу статистично доведеного маркера не виявлено.
Кількість зареєстрованих випадків хвороби Паркінсона в країнах ЄС становить від 112 у Швеції до 229,3 в Італії на 100 000 населення. Мала кількість зареєстрованих випадків хвороби Паркінсона на території України (59,6 на 100 000 населення) може бути пов’язана з гіподіагностикою цієї недуги
Міжнародний неврологічний журнал. – 2012. – № 7 (53)
Визначні відкриття у вивченні хвороби Паркінсона
1817 р.: Джеймс Паркінсон, лікар загальної практики у Лондоні описав шість випадків «тремтливого паралічу» та склав визначення неврологічного стану на основі симптомів. Це описання прогресування хвороби залишається значною мірою дійсним і сьогодні: м’язова ригідність, гіпокінезія, тремор, постуральна нестійкість [1].
1912 р.: невропатолог Фредерік Леві, працюючи з Алоїзом Альцгеймером, використав технології забарвлення на посмертному мозку пацієнтів з хворобою Паркінсона. Всередині різних груп підкоркових нейронів Леві виявив своєрідні білкові агрегати, які пізніше будуть названі на його честь — тільця Леві. Він досліджував варіативність у виникненні цих агрегатів. Починається дискусія про зв’язки між тільцями Леві та хворобою Паркінсона.
1919 р.: невропатолог Костянтин Третьяков повідомив, що втрата нейронів чорної субстанції (substantia nigra) мозку є патологічною ознакою як хвороби Паркінсона, так і постенцефалітного паркінсонізму, стану, що може виникнути у людей після вірусної інфекції. Але його опоненти вважають, що патологія Паркінсона вкорінюється в іншій частині мозку — в стріатумі.
1960 р.: Олег Горнікевич та Герберт Ерінгер в університеті Відня досліджують рівні допаміну в посмертному мозку двох пацієнтів з хворобою Паркінсона та чотирьох — з постенцефалітним паркінсонізмом. У всіх шести хворих рівень допаміну в стріатумі був нижчим, ніж у здоровому мозку. Через кілька років дослідники встановили, що допамін стріатуму походить від нейронів, що знаходяться у substantia nigra [2].
1961 р.: з метою відновлення рівня допаміну Олег Горнікевич та Вальтер Біркмайєр призначають пацієнтам леводопу — ЛП допаміну. Через кілька годин нерухомі пацієнти почали рухатися, ефект тривав майже добу. Препарат виявився успішним і у хворих з постенцефалітним паркінсонізмом. Його було схвалено до застосування у 1970 р. [3].
Червень 1997 р.: група, яку очолював генетик Міхаель Полімеропулус в Національному інституті здоров’я в м. Бетесда (штат Меріленд, США), виявив мутацію, що спричиняє спадкову форму хвороби Паркінсона. Цей ген продукує білок α-синуклеїн. Пізніше також було встановлено, що мутації цього гена зумовлюють рідкісні успадковані випадки захворювання [4].
2008 р.: групи з Університетів Раша в Чикаго (штат Іллінойс) і Лунд в Швеції встановили, що фетальні нейрони, які раніше були пересаджені в мозок людей з хворобою Паркінсона для відновлення продукції допаміну, створюють структури, подібні до тілець Леві. Це свідчить про те, що хвороба може уражати молоду, здорову тканину. Виникають нові гіпотези, у тому числі про ймовірність того, що білок α-синуклеїн може поширюватися від клітини до клітини, як і інфекційні білки, які називаються пріонами [5].

Зображення фібрил патогенного білка α-синуклеїну, отриманого в лабораторії хімічної біології В. Швадчаком та колегами в Празі
Питання друге: яка роль α-синуклеїну?
Генетики визначили, що ген SNCA, який кодує α-синуклеїн, є причиною успадкованої хвороби Паркінсона. Відомо, що мозок хворих містить характерні згустки α-синуклеїну. Синуклеїни — родина білків, які виявляють в нервовій тканині і в деяких видах пухлин.
Вчені довели, що α-синуклеїн міститься не тільки в тільцях Леві, але й у пухлинах головного мозку (гангліомі, медулобластомі), а також в нюхових цибулинах і в передньому нюховому ядрі мозку. Якщо він є однією з причин хвороби Паркінсона, тоді терапія, що зупиняє його агрегацію, може сповільнити або навіть припинити прогресування захворювання.
Дослідники визначили, що α-синуклеїн поширюється через нервові зв’язки у понад 40 регіонів мозку протягом більше одного року за анатомічними шляхами в системі нюху. Погіршення нюху підтверджує думку про те, що хвороба починається саме в нюховій цибулині мозку. Якщо втрачається відчуття запаху, то вже через десять років у таких пацієнтів діагностують хворобу Паркінсона.
Якщо теорія пріонів отримає підтвердження, це забезпечить безліч стратегій для діагностики і лікування пацієнтів з хворобою Паркінсона. Зокрема стане можливою рання діагностика паркінсонізму, якщо α-синуклеїн буде виявлено в крові або у цереброспінальній рідині.
Незалежно від того, чи є агрегати α-синуклеїну пріонами, протеїн бере участь у прогресуванні хвороби Паркінсона. Кілька експериментальних видів лікування, які блокують α-синуклеїн, перебувають на ранній фазі клінічних випробувань. Вчені розробляють технології візуалізації для виявлення α-синуклеїну в мозку. Це також може допомогти в ранній діагностиці хвороби.
Українські вчені — в лідерах вивчення хвороби Паркінсона
Серед науковців АН Чеської Республіки, нагороджених престижною премією Отто Віхтерле, є і українець Володимир Швадчак. Його наукова робота присвячена вивченню молекулярних основ патогенезу хвороби Паркінсона, зокрема, властивостей α-синуклеїну, та пошуку нових методів його інгібування. Володимир Швадчак закінчив хімічний факультет Київського національного університету імені Тараса Шевченка, працював в Інституті органічної хімії АН України, згодом отримав ступінь доктора фармації на фармацевтичному факультеті Університету в Страсбурзі, а цього року його працю було відзначено престижною премією.
Нейродегенеративні захворювання, такі як хвороби Паркінсона та Альцгеймера, повільно прогресують. Спочатку це розглядали як показник зниження функції, пов’язаної зі старінням. Але є свідчення того, що в цих розладах «щось» поширюється в мозку:
— Це одне з найбільш суперечливих питань у вивченні молекулярних механізмів патогенезу, — каже В. Швадчак. — Якщо теорія про «інфекційно-пріонну природу» α-синуклеїну підтвердиться, це не тільки матиме величезні наслідки для діагностики та лікування, але й змінить розуміння того, який тип захворювання є паркінсонізмом.
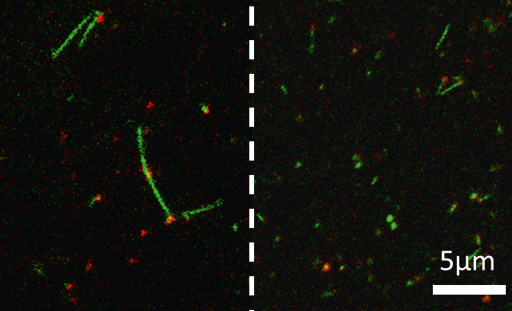
Інгібування утворення фібрил α-синуклеїну під дією інгібітора, отриманого українськими вченими (зліва утворилися довгі фібрили без інгібітора, а справа довгі фібрили не утворені, оскільки діє інгібітор)
Зокрема, В. Швадчак з колегами розробили інгібітор, який селективно зв’язує зростаючі кінці фібрил α-синуклеїну і створює стеричні перешкоди для зв’язування мономерних фібрил α-синуклеїну.
— Цей підхід дозволяє гальмувати утворення фібрил у концентраціях, що набагато нижчі, ніж такі мономерного α-синуклеїну, — продовжує вчений. — Ми вивчали його кінетичний механізм in vitro та визначили реакції, що обмежують ефективність інгібування. Також ми встановили, що блокування кінців фібрил α-синуклеїну є ефективним підходом до інгібування росту фібрил цього білка і дає уявлення про створення ефективних інгібіторів агрегації α-синуклеїну. В майбутньому це сприятиме створенню ефективних ліків.
Питання третє: яка роль патології травного тракту в розвитку хвороби Паркінсона?
Якщо патологія, що призводить до розвитку хвороби Паркінсона, розпочинається у кишечнику, то можливо її зупинити ще на рівні травного тракту. Відомо, що у пацієнтів з хворобою Паркінсона часто є порушенння травного тракту, які виникають до появи моторних симптомів.
Агрегати α-синуклеїну виявляють в нейронах кишечнику, але незрозуміло, чи його патологія призводить до проблем із мозком чи, навпаки, мозкові проблеми поширюються на кишечник. Зусилля, спрямовані на з’ясування процесів, що відбуваються на ранніх стадіях хвороби, допоможуть визначити роль патології кишечнику в розвитку паркінсонізму.
Наразі актуальним є визначення зв’язку травний тракт — мозок — мікробіота.
Питання четверте: як найкращим чином диференціювати різні форми Паркінсонізму?
Для розроблення адекватної схеми лікування паркінсонізму потрібно правильно діагностувати форми цієї хвороби, що допоможе також і в створенні нових лікарських препаратів. Відомо, у пацієнтів із тремором кращий прогноз, ніж у хворих з жорсткістю рухів, повільністю або немоторними симптомами. Вважають, що розвиток паркінсонізму зумовлюють різні механізми, але дані про поширеність цих форм серед людей відсутні.
Cписок літератури знаходиться в редакції
Руслан Редькін, канд. фарм. наук
“Фармацевт Практик” #7-8′ 2018