Чи можна жменю таблеток замінити на одну із запрограмованим вивільненням компонентів?
Людям з хронічними хворобами та особам похилого віку часто доводиться протягом дня приймати кілька лікарських засобів, причому часто їх слід ковтати не одночасно, а через певні фіксовані проміжки часу: щось до їди, щось після, щось через 2 години після їди, але не менше ніж за годину до іншого препарату. Очевидно, що подібні схеми дуже ускладнюють життя та ведуть до порушень лікарських призначень: хворі забувають приймати ліки, відмовляються від них, приймають неправильно, провокуючи небажані ефекти та взаємодії. Для вирішення цієї проблеми вчені прагнуть створити лікарську форму, яка б забезпечила почергове вивільнення різних компонентів у фіксований час. Вже маємо на цьому фронті певні успіхи!
Вчені з Мюнхенського технічного університету створили* модель засобу, три компоненти якого вивільняються по черзі в чітко визначений час. Вони пояснюють, що їх принцип може бути застосований для різних цілей, наприклад, в мазях для лікуванні хірургічних ран, в яких може бути доцільно спочатку вивільняти знеболювальний, потім протизапальний, а ще через деякий час – протинабряковий засіб.
Автори роботи зазначають, що мазі із затримкою вивільнення активних компонентів не є новинкою, але досі немає форм, які гарантують, що два або більше компонентів не вивільняться одночасно.
Нова розробка, окрім активних компонентів, містить гідрогель та штучну ДНК. Для її тестування автори використали наночастинки срібла, оксиду заліза та золота – за їх вивільненням з гідрогелю як носія можна спостерігати за допомогою спектроскопії. Спеціальним компонентом, що відповідав за контроль вивільнення наночастинок, стала штучна ДНК.
ДНК – це звісно, перш за все, носій генетичної інформації. Але, завдяки здатності фрагментів ДНК взаємодіяти між собою з величезною точністю, її використовують для створення наномашин – пристроїв нанорозмірного масштабу.
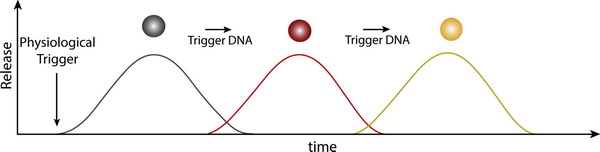
В новій модельній системі першими з гідрогелю вивільнялися наночастинки срібла. В початковому стані вони були зв’язані між собою за допомогою фрагментів ДНК, послідовність яких визначила спеціальна комп’ютерна програма. Отримані конгломерати наночастинок були такі великі, що не могли рухатися і утримувалися в порах гідрогелю. Щоб імітувати умови людського організму, до гідрогелю додавали фізіологічний розчин, під дією якого частинки відокремлювалися від ДНК, конгломерати розпадалися і частинки починали рухатися та вивільнялися з гелю.
Читайте також: Нанодоставка лекарств с контролируемым высвобождением
На наступному етапі відбувалося розчинення конгломератів наночастинок оксиду заліза з ДНК. Ці структури містили два типи ДНК – перший одним кінцем був приєднаний до наночастинок, тоді як другий – до вільного кінця фрагментів першого типу. Фізрозчин на їх зв’язки не впливав. Після розчинення конгломератів з наночастинками срібла ДНК, що вивільнилася, звільнювала від ДНК другого типу наночастинки оксиду заліза. В результаті конгломерати наночастинок оксиду заліза розвалювалися та останні отримували можливість вивільнятися з гідрогелю. Це, в свою чергу, забезпечувало появу в гідрогелі фрагментів ДНК, які руйнували “зшиті” ДНК конгломерати наночастинок золота.
Автори розробки впевнені, що їх принцип вивільнення компонентів лікарського засобу, керований ДНК, може бути застосований не тільки в препаратах для зовнішнього застосування (мазей, гелів), а й в пероральних лікарських формах.
* Kimna C and Lieleg O. Engineering an orchestrated release avalanche from hydrogels using DNA-nanotechnology // Journal of Controlled Release, 2019, 304: 19-28. doi: 10.1016/j.jconrel.2019.04.028.