Европейский Союз: преодоление разрыва «эффективность-результативность»
Внедрение новых технологий здравоохранения в реальную медицинскую практику, а также проблемы переносимости и валидности данных рандомизированных клинических испытаний в реальной клинической практике привлекли внимание Европейской Комиссии и фармацевтической промышленности ЕС. Сейчас происходит смена парадигмы доказательной медицины, которая ранее основывалась исключительно на данных рандомизированных контролируемых клинических испытаний как вершине и «золотом стандарте» доказательности
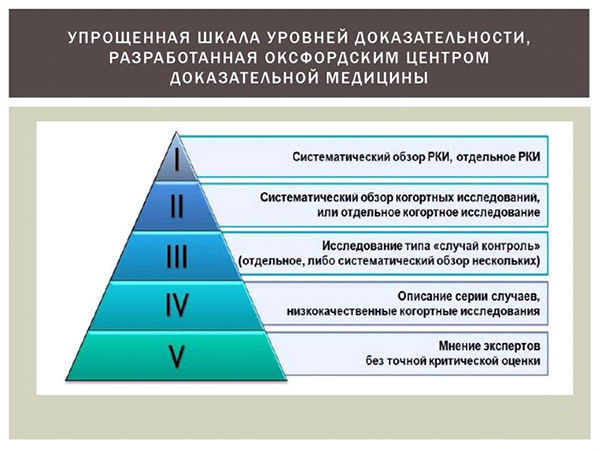
Рис.1. Старая парадигма медицины, основанной на доказательствах
В 2007 году Комиссия ЕС выдвинула предложение о создании совместного проекта Инициатива Инновационных лекарственных средств (Innovative Medicines Initiative Joint Undertaking, IMI) с Европейской Федерацией Ассоциаций фармацевтических производителей (European Federation of Pharmaceutical Industries and Associations, EFPIA). Основной целью проекта IMI является улучшение эффективности и результативности процесса разработки лекарственных средств, а также долгосрочная задача — разработка и производство более эффективных и безопасных лекарственных средств.
IMI (GetReal About IMI) является самым крупным публично-частным партнерством в ЕС направленным на улучшение процесса разработки лекарственных средств путем поддержки новых открытий и создания возможностей для более эффективных методов разработки лучших и безопасных для пациентов лекарственных средств
Исследовательский консорциум, который принимает участие в проектах IMI состоит из крупных биофармацевтических компаний, которые являются членами EFPIA, а также ряда других партнеров — малые и средние предприятия, пациентские организации, университеты и исследовательские организации, больницы, регуляторные агентства государств-членов ЕС и другие индустриальные партнеры.
В рамках инициативы IMI в октябре 2013 года стартовал 3-х летний проект GetReal, публично-частный консорциум состоящий из фармацевтических компаний, академических учреждений, агентств по оценке технологий здравоохранения (например, Национального института клинического мастерства Великобритании — NICE, Национальной службы здравоохранения Франции — HAS), регуляторных органов (например, Европейского Медицинского Агентства — ЕМА, Национального института здравоохранения Нидерландов — ZIN), пациентских организаций и представителей малого и среднего бизнеса. (GetReal. New methods for RWE collection and synthesis)
Основная цель проекта GetReal — разработка, рассмотрение и внедрение новых надежных методов сбора и синтеза доказательств реальной клинической практики (RWE) для того, чтоб как можно раньше использовать их в процесс разработки инновационных лекарственных средств. Кроме того, это позволит ускорить процесс принятия решений в области здравоохранения по включению новых лекарственных средств в клиническую практику и их реимбурсации с использованием доказательств реальной клинической практики (RWE). Работа в проекте потребовала от компаний и учреждений, ответственных за принятие решений в области здравоохранения, и других заинтересованных сторон огромной совместной работы для достижения консенсуса. Результатом стала разработка и представление альтернативных стратегий получения и предоставления доказательств эффективности и безопасности лекарственных средств, включая обоснования для их реимбурсации. Эти наработки позволят быстрее принимать решения лицам, отвечающим за экономическое обоснование внедрения технологий здравоохранения в государствах ЕС, а также предоставят доступ пациентов к новым методам лечения. Причем данные методы анализа адаптированы к системам здравоохранения и существующим медицинскими практикам государств ЕС.
Наработки проекта можно найти на сайте в разделах Research papers (GetReal Research papers), Presentations (GetReal Presentations). Для разработки дизайна прагматических клинических испытаний и оценки протоколов клинических испытаний на предмет их прагматичности был разработан образовательный инструмент и инструмент для принятия решений PragMagic (PragMagic).

PragMagic дает возможность оценить возможные последствия выбора более прагматического дизайна клинических испытаний, операционные сложности, связанные с этим, а также обобщаемость (переносимость) данных в реальную клиническую практику, риски систематических ошибок оценки результатов исследования, точность данных, приемлемость с этической точки зрения и с точки зрения заинтересованных лиц и организаций, влияние на стоимость и длительность исследования.
Для образовательных и практических целей был создан ресурс Real-world evidence (RWE) Navigator (Real-world evidence (RWE) Navigator – https://rwe-navigator.eu/), который помогает пользователям больше узнать о потенциальных проблемах при демонстрации относительной результативности новых лекарственных средств (проблемы разрыва «эффективность – результативность»). Кроме того, ресурс предоставляет специальные типы анализа и дизайна исследований, основанных на данных о применении лекарственных средств в реальной клинической практике для поддержки разработки новых лекарственных средств. Real-world evidence (RWE) Navigator является своего рода всеобъемлющим ресурсом, предоставляющим результаты многочисленных работ в рамках проекта GetReal, а также другие авторитетные источники информации по RWE.
Читайте также статью Виталия Усенко: Новые подходы к определению эффективности лекарственных средств. Смена парадигмы доказательной медицины
Одним из продуктов проекта GetReal стала серия из 8 публикаций «Прагматические клинические испытания и реальная клиническая практика (Pragmatic trials and real world evidence), которые были опубликованы в журнале Клиническая Эпидемиология (Journal of Clinical Epidemiology) c августа по ноябрь 2017 года. Эта серия публикаций включает литературные обзоры, интервью с заинтересованными сторонами из академических учреждений, научно – исследовательских институтов, контрактных исследовательских организаций, представителями фармацевтической промышленности, медицинского страхования, агентств по оценке технологий здравоохранения, врачей и пациентских организаций:
Часть 1: Введение в прагматические клинические испытания и доказательства реальной клинической практики. Series: Pragmatic trials and real world evidence: Paper 1. Introduction. Journal of Clinical Epidemiology. August 2017. Volume 88, Pages 7–13. DOI: https://dx.doi.org/10.1016/j.jclinepi.2016.12.023
Часть 2: Выбор и включение сайтов для исследований лекарственных средств в реальной клинической практике. Series: Pragmatic trials and real world evidence: Paper 2. Setting, sites, and investigator selection. Journal of Clinical Epidemiology. August 2017. Volume 88, Pages 14–20. DOI: https://dx.doi.org/10.1016/j.jclinepi.2017.05.003
Часть 3: Набор, включение, удержание пациентов в прагматических клинических испытаниях. Series: Pragmatic trials and real world evidence: Paper 3. Patient selection challenges and consequences. Journal of Clinical Epidemiology. September 2017. Volume 89, Pages 173–180. DOI: https://dx.doi.org/10.1016/j.jclinepi.2016.12.021
Часть 4: Проблемы и сложности при оформлении информированного согласия для прагматических клинических испытаний. Series: Pragmatic trials and real world evidence: Paper 4. Informed consent. Journal of Clinical Epidemiology. September 2017. Volume 89, Pages 181–187. DOI: https://dx.doi.org/10.1016/j.jclinepi.2017.03.019
Часть 5: Вопросы, возникающие при проведении прагматических клинических испытаний и использовании доказательств реальной клинической практики, препараты сравнения, выбор стратегий лечения для сравнения. Series: Pragmatic trials and real world evidence: Paper 5. Usual care and real life comparators. Journal of Clinical Epidemiology. October 2017. Volume 90, Pages 92–98. DOI: https://dx.doi.org/10.1016/j.jclinepi.2017.07.001
Часть 6: Выбор и измерение результатов лечения в прагматических клинических испытаниях. Series: Pragmatic trials and real world evidence: Paper 6. Outcome measures in the real world. Journal of Clinical Epidemiology. October 2017. Volume 90, Pages 99–107. DOI: https://dx.doi.org/10.1016/j.jclinepi.2016.12.022
Часть 7: Мониторинг безопасности и правила проведения, контроль качества прагматических клинических испытаний. Series: Pragmatic trials and real world evidence: Paper 7. Safety, quality and monitoring. Journal of Clinical Epidemiology. November 2017. Volume 91, Pages 6–12. DOI: https://dx.doi.org/10.1016/j.jclinepi.2017.05.004
Часть 8. Сбор и управление данными прагматических клинических испытаний. Series: Pragmatic trials and real world evidence: Paper 8. Data collection and management. November 2017. Volume 91, Pages 13–22. DOI: https://dx.doi.org/10.1016/j.jclinepi.2017.07.003
Виталий Усенко, Медицинский директор ПАО «Фармак», MD, магистр управления международным бизнесом, магистр по управлению качеством

