Новые подходы к определению эффективности лекарственных средств. Смена парадигмы доказательной медицины
Разрыв «эффективность-результативность»
Очень часто лекарственные средства не показывают таких же успешных результатов эффективности и безопасности в клинической практике как те, что были продемонстрированы во время рандомизированных контролируемых клинических испытаний. Эта проблема получила название разрыв «эффективность-результативность» (efficacy-effectiveness gap). По данным ВОЗ (2003), современные лекарственные средства неэффективны у:
- 40% больных депрессиями;
- 70% больных язвенной болезнью;
- 75% больных с гиперлипидемиями;
- 75% больных бронхиальной астмой;
- 75% больных с мигренью;
- 75% больных сахарным диабетом;
- 75% больных артериальной гипертензией;
- 60% больных мигренью;
- 50% больных артрозами;
- 75% больных шизофренией.
Большинство лекарственных средств эффективны лишь у 25-60% пациентов. Под эффективностью (efficacy) понимается степень пользы лекарственного вмешательства в идеальных условиях (рандомизированные контролируемые клинические испытания), в то время как под результативностью (effectiveness) понимается степень пользы в обычных условиях медицинской практики.
Во время предрегистрационных рандомизированных контролируемых клинических испытаний стараются минимизировать изменчивость групп путем соблюдения жестких критериев включения и исключения. Цель этих критериев — выбор субпопуляции, которая максимально сильно может реагировать на лекарственное средство (high-responders) и в наилучшей степени переносит его (good-toleraters). Минимизируя изменчивость путем создания гомогенных групп пациентов с высокой чувствительностью к воздействию и низкой чувствительностью к токсическим эффектам экспериментального лекарственного средства, компании добиваются усиления соотношения «сигнал-шум». Это необходимо для более успешного выделения эффекта лекарственного средства и отделения его от фона.
Например, в исследование могут не включаться группы больных с определенными сопутствующими заболеваниями или принимающими определенные лекарственные средства. Это позволяет в максимальной степени продемонстрировать фармакологический и/или биологический эффект лекарственного средства и максимально положительное соотношение «польза-риск». После регистрации лекарственного средства и применения его у широких слоев населения в реальной клинической практике, где присутствует большая изменчивость между больными, чем в условиях эксперимента, может возникнуть изменение эффективности лекарственного средства и резкое снижение соотношения «польза-риск».
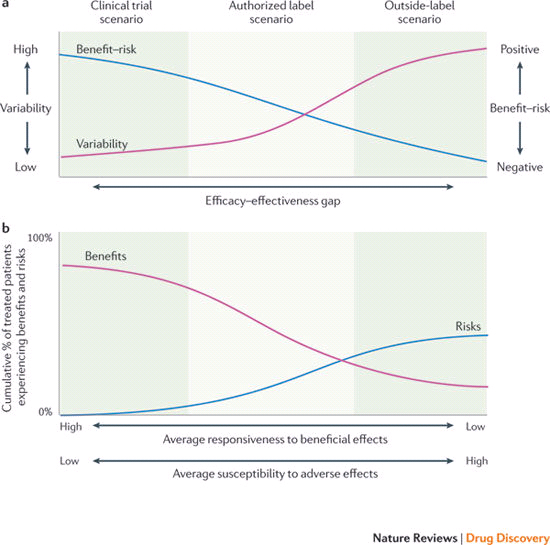
Рис. 1. Ухудшение соотношения польза-риск после начала применения лекарственного средства в реальной клинической практике. Среднее соотношение польза-риск как функция сценария медикаментозного лечения
Регуляторные органы оценивают лекарственное средство с точки зрения доказательств его биологического или фармакологического эффекта и соотношения «польза-риск», полученных в результате проведения предрегистрационных исследований. Но будет ли в полной мере достигнут потенциал лекарственного средства при его применении в реальной жизни? Ответ на этот вопрос важен для оценки технологий здравоохранения, определяющих целесообразность включения препарата в протоколы лечения и экономическую обоснованность его реимбурсации.
Ухудшение соотношения «польза-риск» в реальной клинической практике может быть связано с потреблением лекарственных средств теми слоями населения, которые были отсечены в рандомизированных контролируемых клинических испытаниях.
Изменчивость (вариабельность) действия лекарственного средства
Факторы, которые влияют на изменчивость эффективности и безопасности лекарственного средства.
I. Биологические факторы
1. Генетические факторы изменчивости (фармакогенетика и фармакогеномика)
Известно, что от 20 до 90% эффективности лекарственного средства зависят от генетических факторов. Причиной того, что препарат не действует, может быть отсутствие в организме ферментов, которые расщепляют пролекарства до метаболитов.
2. Негенетические факторы изменчивости (внутренние и внешние):
- Внутренние негенетические факторы изменчивости – различные физиологические и патофизиологические состояния организма (возраст, пол, масса тела, сопутствующие заболевания, тяжесть заболевания)
- Внешние негенетические факторы изменчивости – влияние окружающей среды (загрязнение среды, воздействие солнечного света, прием сопутствующих лекарственных средств, влияние продуктов питания на фармакокинетику)
Повышение солнечной активности приводит к активации свертывающей и угнетению противосвертывающей систем крови. Рекомендация клинического фармацевта — в первые дни магнитных бурь (лучше за день до ее начала) принять ацетилсалициловую кислоту для профилактики тромбозов
II. Поведенческие факторы
1. Практики назначения и применения лекарственного средства профессионалами здравоохранения
Регуляторы одобряют лекарственное средство с определенными показаниями и в определенных условиях применения. Однако ежедневное использование лекарственного средства в «системе медикаментозного использования» (medical use system) может показать другую картину.
Система медикаментозного использования — это комплексное взаимодействие между врачами, медсестрами, провизорами, фармацевтами, персоналом лечебного учреждения и другими профессионалами здравоохранения, которые могут повлиять на использование лекарственного средства в ежедневной практике
Например, ненадлежащее назначение лекарственного средства; назначение не по одобренным показаниям (off-label use); в комбинации с несовместимым лекарственным средством; продолжение приема препарата пациентами, у которых отсутствует реакция на лечение; назначение лекарственного средства больным, которым оно противопоказано; медицинские ошибки. В ряде случаев, применение лекарственного средства не по одобренным показаниям базируется на доказательствах, которые не были рассмотрены регуляторными органами и могут принести пользу больному. Однако, чаще всего, такое использование препарата способствует расширению разрыва «эффективность-результативность» и приводит к более частому возникновению побочных реакций.
Медицинские ошибки в системе медикаментозного использования при применении лекарственного средства включают в себя ошибки при отпуске лекарственных средств (отпуск неправильного лекарственного средства, не той дозировки, не той лекарственной формы), неправильное обращение или нарушения способа применения лекарственного средства (часто при применении рентген-контрастных препаратов), неправильное хранение лекарственного средства.
2. Соблюдение больным режима лечения (приверженность режиму лечения)
В ряде исследований, которые проводилась в развитых странах, обнаружилось, что соблюдение больными режима лечения при терапии хронических заболеваний составило в среднем 50%. Под несоблюдением режима лечения понимают: нарушение времени приема, пропуска приема, непостоянный прием лекарственного средства, назначенного для лечения хронических заболеваний. Несоблюдение режима прима лекарственного средства при его применении в широкой клинической практике является одной из значимых причин изменчивости эффективности лекарственного средства и одним из важнейших факторов возникновения разрыва «эффективность-результативность».
В некоторых ситуациях приверженность режиму лечения имеет более важное значение, чем просто своевременный прием лекарственного средства. Лечение может включать помимо фармакотерапии диету и лечебную физкультуру. Отказ от изменения образа жизни во время фармакотерапии может значительно снизить терапевтический эффект от применения лекарственного средства. Так, исследования показали, что эффективность метотрексата и ингибиторов TNF у больных ревматоидным артритом значительно ниже у курящих, чем у некурящих больных.
Преодоление разрыва «эффективность-результативность»
Отсутствие внешней валидности является большим недостатком премаркетинговых рандомизированных контролируемых клинических испытаний. Подобный вид испытаний называется «объясняющими» исследованиями (explanatory trials) или исследованиями эффективности (efficacy trials). Реальная клиническая практика и принятие решений о целесообразности реимбурсации требуют внешней валидности клинического испытания. Клинические испытания с высокой внешней валидностью относятся к прагматическим клиническим испытаниям (‘pragmatic’ clinical trials – PCTs) или испытаниями по результативности применения лекарственного препарата в реальной клинической практике (effectiveness trials).
Контролируемые рандомизированные клинические испытания (РКИ), прагматические клинические испытания и обсервационные исследования. Данные реальной клинической практики
В последнее время регуляторные органы, агентства по оценке технологий здравоохранения, операторы здравоохранения и фармацевтического сектора ЕС обратили внимание на возможность переноса результатов клинических испытаний в реальную клиническую практику (обобщение и обобщаемость). Обобщение в КИ — это возможность применения результатов КИ для популяции больных в конкретной клинической ситуации. Степень, с которой результаты того или иного КИ могут быть соотнесены с конкретной популяцией и с конкретной клинической ситуацией, называется обобщаемость.
Иногда термин «внешняя валидность» используется для обозначения обобщаемости, однако это не совсем корректно. Валидность — это мера соответствия методик и результатов исследования поставленным задачам. Выводы могут быть совершенно верными (валидными), но не применимыми к другой группе пациентов и, следовательно, не являться обобщаемыми. Конечно, валидность должна быть гарантирована в первую очередь. Далее должна быть возможность обобщения результатов исследования для более широкой популяции. Перед РКИ стоит задача доказательства биологического (фармакологического) эффекта лекарственного средства (объясняющие исследования), а не определения насколько хорошо оно работает в реальной клинической практике в гетерогенной популяции или сравнения стратегий лечения. Поэтому даже если качественно проведенное РКИ валидно, это не означает, что такие же результаты будут показаны в реальной клинической практике.
В связи с этим внимание регуляторов, агентств по оценке технологий здравоохранения, спонсоров клинических испытаний привлекли доказательства, полученные в реальной клинической практике (Real-World Evidence – RWE) и исследования в реальной клинической практике (RWE studies).
Доказательства, полученные в реальной клинической практике путем анализа и/или синтеза данных терапевтического вмешательства (данные по безопасности, эффективности, использовании ресурсов и т.д.), собираются за пределами строго контролируемых РКИ. Предполагается, что RWE предоставляют собой данные по терапевтическому вмешательству в условиях реальной жизни, включая относительную эффективность. Относительная эффективность терапевтического вмешательства — это степень, в которой вмешательство приносит больше пользы, чем вреда, по сравнению с одним или несколькими альтернативными терапевтическими вмешательствами в обычных условиях в практике здравоохранения той или иной страны/региона.
Хорошо разработанные обсервационные исследования широко используются для генерирования данных реальной клинической практики. Обсервационные исследования предназначены для исследования эффективности нового препарата или метода лечения в повседневной клинической практике без изменения нормального поведения больного и врача.
Кокрановский обзор 2014 года пришел к выводу о том, что имеется мало свидетельств того, что существуют значительные отличия между обсервационными исследованиями и РКИ в оценках эффективности и безопасности лекарственных средств.
Тем не менее возникла необходимость привнесения элемента рандомизации в исследования для получения более валидных данных реальной клинической практики (Real-World Data — RWD). Рандомизация в клинических испытаниях — это гарантия того, что на измерения пользы/риска лекарственных средств в экспериментальной и контрольной группах не будут влиять различия, не связанные с экспериментом. Рандомизация направлена на устранение различий как неизвестных, так и известных факторов, приводящих к прогностической несопоставимости результатов между группами больных. Так возникла идея о прагматических клинических испытаниях.
Прагматические клинические испытания, впервые представленные Шварцем и Леллухом, объединяют преимущества обсервационного исследования в реальной клинической практике с научной строгостью рандомизированного исследования, что дает ответы на многие вопросы, имеющие отношение к повседневной реальной клинической практике. Эти данные особенно актуальны, если уже существуют различные методы лечения исследуемого заболевания, а ситуация в реальной клинической практике, включая влияние посторонних факторов, может повлиять на терапевтический эффект.
Идеальное прагматическое клиническое испытание направлено на выявление полного эффекта от стратегии лечения в реальной клинической практике с высокой степенью валидности. Это подразумевает сравнение рандомизированных групп больных сходных с целевой группой в отношении характеристик, которые могут изменять реакцию на лекарственное средство в условиях реальной клинической практики. Для этого используют компараторы и результаты, которые применяют в лечении пациентов в рутинной клинической практике.
Рандомизированные контролируемые клинические испытания (объясняющие испытания, испытания эффективности, explanatory trials, efficacy trial) и прагматические клинические испытания (испытания результативности в реальной клинической практике, pragmatic trials, effectiveness trials) представляют собой противоположные концы одного континуума рандомизированных клинических испытаний. В реальной жизни исследование может быть ближе или к одному, или к другому концу континуума и они могут содержать элементы друг друга. Общее между ними то, что и те и другие исследования являются рандомизированными, хотя методы рандомизации в них отличаются.
Рис. 2. Континуум рандомизированных клинических испытаний.
|
<-объясняющие |
испытания |
прагматические-> |
|
Может ли в принципе работать это ЛС? Эффективность – Идеальные условия |
Что? |
Насколько хорошо работает это ЛС? Результативность – Сравнение стратегий лечения – Обычное лечение |
|
Оценка причинно-следственной связи эффективности ЛС |
Почему? |
Информирование лиц, принимающих решение |
|
Минимизация вариабельности – Жесткий протокол |
Как? |
Максимизация обобщаемости – Протокол отражает обычный режим лечения |
|
Селективное включение в испытание |
Кто? |
Широкое включение в исследование |
|
– Сбор данных > обычный режим – Результат релевантный исследованию |
Метод? |
– Сбор данных = обычный режим – Результат релевантный клинической практике |
Прагматические испытания чем-то внешне похожи на обсервационные исследования. Как первые, так и вторые – это клинические исследования, в которых собираются данные путем наблюдения событий в их естественном течении (без вмешательства), то есть в реальной клинической практике. Данные полученные в результате этих исследований относятся к данным реальной клинической практики (RWE). Однако обсервационные исследования стоят особняком от прагматических, так как в них нет рандомизации. Соответственно, они могут уступать прагматическим испытаниям по уровню достоверности.
Виталий Усенко, Медицинский директор ПАО «Фармак», MD, магистр управления международным бизнесом, магистр по управлению качеством


