Масс-спектрометрия: зачем «взвешивать» молекулы?
Развитие методов диагностики и терапии в современной медицине немыслимо без соответствующего приборного обеспечения. Среди огромного количества самых разнообразных приборов, используемых в лабораториях и лечебных учреждениях, особое значение имеет применение масс-спектрометрии. Несмотря на более чем столетний возраст данного метода, он не только не утратил своих позиций, но и, благодаря все новым модификациям, открывает дальнейшие возможности как в биохимии, так и медицине
Необходимый мониторинг
Одной из важнейших задач современной медицины является проведение терапевтического лекарственного мониторинга в целях обеспечения оптимальной концентрации лекарственных средств в месте его действия. Прежде всего это касается антибиотиков, антиаритмических препаратов, антиконвульсантов и др., имеющих узкий терапевтический коридор, то есть разницу между средней терапевтической и токсической дозами.
Простое измерение концентраций лекарственных средств в крови пациента не всегда обеспечивает успешный результат, даже если речь идет о препарате, терапевтические рамки которого хорошо известны, и по данным двух–трех измерений можно рассчитать необходимую дозу и интервалы дозирования. Назначение целого ряда лекарственных средств в так называемых средних дозах без учета знания концентрации препарата в крови может приводить к непредсказуемым последствиям. Изменение концентрации лекарственных средств в плазме крови может быть вызвано взаимодействием с другими препаратами, пищей, депонированием в тканях, изменением метаболизма.
Основным способом регистрации фармакокинетических данных при проведении терапевтического лекарственного мониторинга является масс-спектрометрия
В связи с этим своевременная информация об изменении концентрации лекарственных средств в крови или в других жидких биологических пробах позволяет лечащему врачу скорректировать терапию. Например, терапевтический лекарственный мониторинг необходим при нелинейной кинетике препарата, когда нет прямой зависимости между его дозой и концентрацией в крови в пределах терапевтического уровня; при очень узком терапевтическом окне (опасность возникновения нежелательных побочных и токсических проявлений); у определенного контингента пациентов (женщины в период беременности и кормления грудью, лица пожилого возраста, грудные дети и т.д.), у которых фармакокинетические параметры, а значит, и границы безопасного терапевтического окна значительно отличаются от обычных средних значений; при нарушениях функции почек, печени или пищеварительного тракта, влияющих на фармакокинетические параметры, а также во многих других ситуациях.
Читайте також: «Премудрости» медицинской метрологии
Основным способом регистрации фармакокинетических данных при проведении терапевтического лекарственного мониторинга является масс-спектрометрия — наиболее совершенный в настоящее время метод анализа состава вещества. Что же представляет собой этот удивительный физико-химический метод исследования веществ?
Масс-спектрометрия – метод, который стал незаменимым
Все началось с исследований Джозефа Джона Томсона, проведенных в Кавендишевской лаборатории Кембриджского университета, благодаря результатам которых в 1897 г. был открыт электрон. В дальнейшем (в 1912 г.) это позволило ученому создать первый масс-спектрометр для изучения влияния электрического и магнитного полей на ионы, генерируемые в остаточном газе на катоде рентгеновской трубки. Дж. Томсон обратил внимание, что эти ионы движутся по параболическим траекториям, зависящим от отношения их массы к заряду. В 1906 г. Дж. Томсон был удостоен Нобелевской премии по физике за вклад в теоретическое и экспериментальное исследование электропроводимости газов.
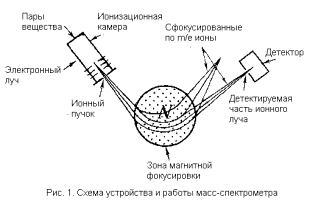
Масс-спектрометрия является методом исследования вещества, основанным на определении отношения массы к заряду ионов, которые образуются при ионизации представляющих интерес компонентов пробы
С помощью первого масс-спектрометра были получены масс-спектры молекул кислорода, азота, угарного газа и фосгена. Регистрацию спектров на этом приборе производили с использованием фотопластинок. В 1919 г., когда детектирование заряженных частиц начали осуществлять не на фотопластинках, а перешли к измерению ионных токов, метод стали называть масс-спектрометрией.
Для получения масс-спектра необходимо превратить нейтральные молекулы и атомы, составляющие любое органическое или неорганическое вещество, в заряженные частицы — ионы. Этот процесс называется ионизацией и по-разному осуществляется для органических и неорганических веществ. Вторым необходимым условием является перевод ионов в газовую фазу в вакуумной части масс-спектрометра. Глубокий вакуум обеспечивает беспрепятственное движение ионов внутри масс-спектрометра, а при его отсутствии ионы рассеиваются и рекомбинируют.
Таким образом, масс-спектрометрия является методом исследования вещества, основанным на определении отношения массы к заряду ионов, которые образуются при ионизации представляющих интерес компонентов пробы. Это один из мощнейших способов качественной идентификации веществ, допускающий также и количественное его определение. Можно сказать, что масс-спектрометрия — это «взвешивание» молекул, находящихся в пробе.
Читайте также: Зачем медицине математика?
Период с 30-х по начало 70-х годов прошлого столетия был отмечен выдающимися достижениями в области масс-спектрометрии. За это время данный метод исследования нашел широчайшее применение и стал незаменимым в аналитической, общей и органической химии, пищевой промышленности, химическом синтезе и нефтехимии, контроле окружающей среды, производстве полимеров и пластиков, а также во многих других областях деятельности человека. Конечно, и такие жизненно важные направления, как биохимия, медицина, фармацевтика и даже косметика, не обходятся без этого метода исследования. Так, например, широкое распространение получила изотопная масс-спектрометрия углеродных атомов при прямой медицинской диагностике инфицированности человека Helicobacter pylori и является самым надежным из всех видов диагностики. Не менее эффективно применение масс-спектрометрии для определения наличия допинга в крови спортсменов и во многих других случаях.
Совершенствование приборных модификаций
Еще в середине 50-х годов прошлого столетия немецкий физик Вольфганг Пол разработал квадрупольный масс-анализатор. Этот анализатор способен разделять ионы с помощью переменного электрического поля. Другой инновационной разработкой ученого было создание квадрупольной ионной ловушки, специально предназначенной для измерения массы ионов.
Первая коммерческая ионная ловушка стала доступной в 1983 г. Ныне квадруполи и квадрупольные ионные ловушки являются наиболее распространенными масс-анализаторами в мире, а за свои работы Вольфганг Пол получил в 1989 г. Нобелевскую премию по физике.
В те же годы впервые были соединены газовый хроматограф и масс-спектрометр. Затем появились новые методы ионизации — химическая ионизация, бомбардировка быстрыми атомами, полевая десорбция/ионизация, лазерная десорбция/ионизация и др. Были разработаны более совершенные приборы для новых применений — масс-спектрометры ионно-циклотронного резонанса и затем — ионно-циклотронного резонанса с Фурье-преобразованием сигнала и тройные квадрупольные тандемные масс-спектрометры.
Масс-спектрометрия в медицине
Применение масс-спектрометрии в медицине и биохимии, бурно развивающихся в последние два десятилетия, привело к революции в этих науках, а создание нового масс-спектрометрического метода анализа сложных биоорганических соединений посредством десорбции ионов из органической матрицы импульсным лазерным излучением, получившего название MALDI (Matrix Assisted Laser Desorption/Ionization), было отмечено Нобелевской премией по химии за 2002 г. Для идентификации биомолекул этот метод применяют в сочетании с технологией TOF (time off light) — разделения ионов в вакууме на основе разного времени их пролета. С помощью технологии MALDI-TOF уже определяют видовую принадлежность патогенов и антибиотикорезистентность бактерий.
На протяжении столетия масс-спектрометрия «училась» справляться со все более тяжелыми массами, единицами измерения которых является дальтон (Да). Так, если самый первый масс-спектрометр мог измерять массу не более 130 Да, то в наше время коммерчески доступные масс-спектрометры работают с белками и полимерами до 1 МДа, а устройства, модифицированные в лабораториях, — с молекулами, масса которых достигает 10 МДа. Массы более тяжелых молекул фактически не поддаются достоверному измерению — ионы, образуемые ими, слишком медленно перемещаются в направлении детектора под воздействием электрических или магнитных полей.
И вот совсем недавно стало известно [1], что новая модификация наномеханического масс-спектрометра с применением метода наноэлектронно-распылительной ионизации впервые позволила точно «взвесить» большой ДНК-вирус массой 105 MДа. Новая аналитическая система позволяет детектировать отдельные молекулы, масса которых выходит за пределы диапазона, характерного для обычных масс-спектрометров. При испытаниях устройства ученые измерили массу 650 вирусов Т5, и после нормализованного распределения масса вируса была определена как 108,4 МДа.
Разработчики отмечают, что акустическая система фокусировки пучка, содержащего частицы с большой массой, может быть легко модифицирована для направления вирусов на наномеханические детекторы иного типа — предназначенные для определения размеров частиц, их формы или жесткости. Понятно, что ставший доступным для масс-спектрометров уровень массы объектов в сотни мегадальтон (МДа) открывает им новые возможности в медицинской науке.
Таким образом, масс-спектрометрия не утратила своих позиций и ее продолжают активно использовать не только в физико-химических, но и в клинических лабораториях крупных мировых медицинских центров [2].
Подготовил Руслан Примак, канд. хим. наук
Литература
- Sergio Dominguez-Medina, Shawn Fostner, Martial Defoort et al. Neutral mass spectrometry of virus capsids above 100 megadaltons with nanomechanical resonators // Science. — 2018; Vol. 362, Issue 6417: P. 918–922.
- Мильман Б.Л., Журкович И.К. Масс-спектрометрический анализ медицинских объектов и проблемы клинической диагностики // Журнал аналитической химии. — 2015; Т. 70, № 10: 1026–1039.
“Фармацевт Практик” #9′ 2019



