Проблема застосування лікарських засобів поза зареєстрованими показаннями
Перш ніж потрапити на ринок, лікарський засіб (ЛЗ) має пройти через процедуру реєстрації, у процесі якої оцінюються його безпека та ефективність. Після оцінки фармацевтичного досьє регуляторні органи видають реєстраційне посвідчення і препарат дозволяється до застосування. Засоби, що потрапили в обіг, мають чіткі характеристики, а саме — показання та протипоказання до застосування, режим призначення, дозування тощо. Інструкція до лікарського засобу розробляється на основі доклінічних і клінічних досліджень, вартість яких для новітніх оригінальних засобів становить сотні мільйонів доларів.
Проте існують труднощі у реєстрації відповідних показань для лікування деяких захворювань та груп пацієнтів. В усьому світі є проблема застосування лікарських засобів для лікування дітей, пацієнтів похилого віку, вагітних, осіб, які потребують паліативної терапії, орфанних, онкологічних і психіатричних захворювань. Реєстраційний процес для цих груп потребує проведення клінічних випробувань, які коштують досить дорого, а інколи немає достатньої кількості пацієнтів для проведення відповідних рандомізованих досліджень або їх неможливо провести з відповідним рівнем доказовості, або протягом проходження складних реєстраційних процедур не було досягнуто всіх умов для реєстрації.
Інша причина — якщо препарат рецептурний та існує багато генериків, то оригінальній і будь-якій генеричній компанії немає сенсу проводити клінічні випробування для реєстрації нових показань. Чим «старіший» препарат, тим менше достовірної інформації про його належне застосування.
Друга проблема перебуває в іншій площині. Завдяки науковому прогресу новітні дані та міжнародні рекомендації з лікування випереджають інформацію, яка зареєстрована в інструкції для медичного застосування або SPC (Summary of Product Characteristic — коротка характеристика лікарського засобу).
Все це є передумовами для застосування лікарями препаратів поза зареєстрованими показаннями («off-label»).
Одним із прикладів застосування «off-label» є пропранолол. За призначення препарату для лікування артеріальної гіпертензії та ішемічної хвороби серця (ІХС) спостерігали, що він запобігає нападам мігрені. За цими показаннями засіб був затверджений через рік після первинної реєстрації.
Інший приклад — бевацизумаб. Для лікування вікової макулярної дегенерації був зареєстрований ранібизумаб. З’явилось багато публікацій про ефективність і безпеку застосування бевацизумабу. Лікарі почали призначати його здебільшого через нижчу ціну.
Габапентин був зареєстрований FDA у 1994 р. як препарат для лікування епілепсії. Але його застосування при невропатичному больовому синдромі та біполярній депресії призвели до зміни і розширення реєстраційних показань.
За даними закордонних джерел, застосування лікарських засобів «off-label» коливається в різних країнах у межах 7,5–40 % у дорослих [1, 2] і близько 90 % — у госпіталізованих педіатричних пацієнтів [3]. Причому відсоток призначень «off-label» без достатнього наукового обґрунтування коливається від 73 %, як це було визначено у дослідженні 2006 р., до 79 % у дослідженні 2016 р. [4, 5]. У порівняно недавньому дослідженні 2012 р., яке було проведене у Канаді, виявлено, що 11 % лікарських засобів застосовуються поза зареєстрованими показаннями [6].
Поширеність застосування лікарських засобів «off-label» в онкологічній практиці становить 50–75 %. Причому таке застосування було менш частим у 80-х роках, оскільки старі ліки мали більше можливостей для вивчення та більш широкі показання для застосування [7, 8].
Чим «старіший» препарат, тим менше достовірної інформації про його належне застосування
Призначення «off-label» переважає у молодих осіб порівняно з пацієнтами похилого віку. У нещодавньому дослідженні застосування лікарських засобів у пацієнток віком старше 65 років, хворих на рак молочної залози, було виявлено, що 13 % серед них отримували щонайменше одне лікування «off-label» [9], хоча цей показник був меншим, ніж у попередніх дослідженнях (35 %) [10].
У дослідженні 2015 р. було виявлено, що онкологічні препарати «off-label» за частотою призначення (у порядку зниження) можна представити у вигляді наступного ряду: вінорельбін, бевацизумаб, лейпрорелін, доксорубіцин ліпосомальний та цисплатин [9]. Дослідженням 2013 р. виявлено, що 2/3 призначень поза зареєстрованими показаннями співвідносились з рекомендаціями Національної загальної онкологічної мережі США (NCCN) [11].
За даними закордонних джерел, застосування лікарських засобів «off-label» коливається в різних країнах у межах 7,5–40 % у дорослих [1, 2] і близько 90 % — у госпіталізованих педіатричних пацієнтів [3]
Інше дослідження виявило, що 45 % пацієнтів отримують щонайменше 1 онкологічний препарат «off-label». Існує також велика різниця між лікуваннями онкологічних захворювань різної локалізації. Так для терапії раку ободової кишки застосовували препарати «off-label» у 10 % пацієнтів, а для лікування мієломи — у 80 %. Було виявлено, що 10 лікарських режимів, які найчастіше застосовують, становлять 30 % усіх «off-label» призначень в онкології [12]. У дослідженні 2010 р. 10 онкологічних препаратів з патентним захистом мали 70 % призначень згідно з показаннями FDA. Серед 30 % «off-label» призначень 14 % відповідали рекомендаціям NCCN, 10 % призначено для лікування раку такої самої локалізації, але іншої стадії захворювання або лінії терапії. Дослідження виявило, що щорічні витрати на застосування «off-label» становлять 4,5 млн. доларів США [13].
Загалом лікарські засоби поза зареєстрованими показаннями в онкології найчастіше застосовують у випадках дуже рідких форм пухлин або тоді, коли немає переконливої відповіді на «дозволене» лікування [14].
Дослідження призначень лікарських засобів за участі 113 лікарів первинної медичної допомоги у провінції Квебек (Канада) виявило, що застосування «off-label» здебільшого стосується популяції пацієнтів, для яких доза препарату не визначена. Препарати для лікування захворювань ЦНС поза зареєстрованими показаннями призначали у 26 % випадків, антиконвульсанти — у 67 %, антипсихотики — у 44 %, антидепресанти — у 33 % [15].
Головним викликом для регуляторних органів і клініцистів у всьому світі є досягнення найкращого лікування педіатричних хворих. Дітям призначають ліки, безпека та ефективність яких часто не визначені або супроводжуються науковими даними низької якості [16]. Більш як половина усіх лікарських засобів не мають специфічного дозування для дітей, що змушує педіатрів вирішувати питання щодо призначення лікування, яке базується на їх клінічному досвіді. Немає достатньої кількості дитячих лікарських форм для застосування препаратів в онкології, кардіології (особливо аритмології), ревматології, коагулогії, епілептології, а також для лікування інфекційних захворювань. У міжнародних дослідженнях виявлено, що застосування лікарських засобів поза зареєстрованими показаннями становить 18–60 % у дітей молодшого віку та близько 90 % у новонароджених [17, 18].
Огляд, який був проведений у 5 лікарнях Європи, визначив, що 39 % ліків призначають дітям «off-label» [19]. Інші дослідження виявили, що у Великій Британії поза зареєстрованими показаннями застосовують близько 11 % лікарських засобів, у Франції — 33 %, а в Нідерландах — 29 %. Австралійське дослідження виявило, що у відділеннях інтенсивної терапії новонароджених близько 80 % препаратів призначають поза офіційних показань [20, 21, 22, 23].
Більш як половина усіх лікарських засобів не мають специфічного дозування для дітей, що змушує педіатрів вирішувати питання щодо призначення лікування, яке базується на їх клінічному досвіді
Результати двох досліджень свідчать, що застосування антибіотикотерапії «off-label» серед педіатричної популяції має дуже широкий діапазон — 1–94 %. У 2000 р. було виявлено, що антибіотиками, які найчастіше призначають «off-label», є амоксицилін та ампіцилін. У близько 96 % випадків їх доза була перевищена, а у 78 % — вони призначались поза показаннями щодо дозування, частоті приймання чи форми випуску [19, 24].
Результати дослідження, проведеного в Індії, яке у 2014 р. були опубліковано у Міжнародному журналі педіатрії, підтвердило, що найчастіше «off-label» госпіталізованим педіатричним пацієнтам призначають антибактеріальні препарати для лікування респіраторної системи (82 %), препарати для парентерального застосування (73 %, найбільша доля припадає на цефтріаксон, амікацин, ванкоміцин, амоксицилін), для лікування захворювань ШКТ (53 %), гормональні препарати (80 %) і препарати для лікування ССС (71 %) [25].
У дослідженні, яке було проведено у відділеннях інтенсивної терапії, застосування ліків поза зареєстрованими показаннями у дорослих становило 32 %. Найбільш поширеними були препарати для лікування респіраторної системи, ШКТ (здебільшого інгібітори протонної помпи — 55 %, лаксативи — 16 %, Н2-блокатори — 15 %) та імунологічні засоби [26, 27].
Більшість іноземних публікацій наголошують, що призначення лікарських засобів «off-label» не заборонене та відповідальність за нього покладається на лікаря
Застосування препаратів поза зареєстрованими показаннями може призвести до серйозних наслідків. Насамперед це стосується побічних явищ та неефективного лікування в разі призначення недостатнього дозування. У досліджені 2015 р. було проведено аналіз виникнення побічних явищ при застосуванні 151305 лікарських засобів у 46021 дорослих пацієнтів. Серед призначень відповідно до зареєстрованих показань побічні явища виникали з частотою 12,5 випадка на 10000 пацієнто-місяців, що майже не відрізнялось від призначень препаратів «off-label» з достатнім науковим обґрунтуванням. Якщо лікарські засоби призначали «off-label» за відсутності наукових даних, які б підтверджували це призначення, побічні явища виникали на 44 % частіше [5]. Також було виявлено, що кількість побічних явищ значно залежала від сукупної кількості призначених лікарських засобів і була у 5 разів вищою за призначення більш як 8 препаратів порівняно із застосуванням 1 або 2 препаратів.
Напрямки вирішення проблеми
Основна мета застосування препаратів «off-label» — домогтися переваг у лікуванні індивідуального пацієнта. Це не означає, що лікарський засіб застосовують неправильно або за наявності протипоказань. Екстраполяція нового застосування лікарського засобу може відбуватись у чотирьох напрямках. По-перше, коли лікар застосовує препарат для лікування нових патологічних станів. По-друге, коли лікар намагається лікувати інші популяції, наприклад дітей замість дорослих. По-третє, коли застосовують інше дозування чи змінюють тривалість лікування, а також при використанні для терапії інших форм препарату (наприклад, застосування пролонгованих форм у випадку зареєстрованих показань для звичайних форм препарату).
Більшість іноземних публікацій наголошують, що призначення лікарських засобів «off-label» не заборонене та відповідальність за нього покладається на лікаря.
Читайте також: Рождение лекарства: проблемы тестирования новых молекул
На деяких сайтах офіційних товариств і регуляторних органів, зокрема, FDA, Американського товариства з лікування раку, Постійної комісії сенату із соціального забезпечення, науки та технологій Канади (The Standing Senate committee on Social Affairs, Science and Technology Senate, Canada), для пацієнтів і лікарів розміщуються пояснення щодо застосування ліків «off-label». У них інформується, що застосування поза зареєстрованими показаннями особливо часто трапляється за призначення старих генеричних препаратів, для яких на основі наукових даних знайдене нове застосування, але формальна реєстрація цих показань дуже дорого коштує і не вигідна для виробників. Інші лікарські засоби, зокрема протипухлинні, можуть бути застосовані проти багатьох видів новоутворень. Крім того хіміотерапія передбачає багатокомпонентні схеми, в яких 1 або 2 препарати можуть не мати офіційних показань до застосування. Взагалі лікування онкологічних захворювань має бути індивідуалізованим, постійно змінюватись та поліпшуватись. Це особливо важливо для дуже рідких видів новоутворень. Американська академія педіатрів наголошує, що лікування має базуватись на «золотих стандартах», які часто є недоступними у терапії дітей. Тому практикуючі лікарі повинні спиратись на думку експертів з приводу лікування конкретних вікових груп пацієнтів або даних щодо терапії інших вікових груп [28].
Більшість іноземних видань роз’яснюють, що за будь-яких обставин лікування має ґрунтуватись на принципах найкращого вибору для пацієнта і на «золотих стандартах», міжнародних або локальних настановах. У нещодавній публікації 2015 р. «Персоналізована медицина: час для однопацієнтних досліджень» автор наголошує, що мільйони пацієнтів приймають ліки, які їм не допомагають. У США 10 препаратів-бестселерів допомагають у середньому 1 з 25 та 1 з 4 пацієнтів, які їх отримують [29]. Мета призначення лікарських засобів «off-label» спрямована на користь для пацієнта. Слід розуміти, що «off-label» не завжди означає, що воно є нелегальним, неправильним, протипоказаним або застосоване з метою вивчення [30].
Взагалі ця практика може бути легальною і виправданою, якщо базується на наукових даних високої якості, в яких задокументовані очікувані та несподівані побічні явища [31, 32]. Деякі автори використовують термін «інноваційне застосування «off-label», що означає призначення лікарського засобу тоді, коли є резонна раціональність його використання, ще немає достатніх даних, щоб розвіяти побоювання щодо безпеки, ефективності та показників ціна–ефективність для інноваційного препарату, і у випадку, коли немає висновків клінічних досліджень щодо протипоказань засобу [32].
Американська академія педіатрів наголошує, що лікування має базуватись на «золотих стандартах», які часто є недоступними у терапії дітей
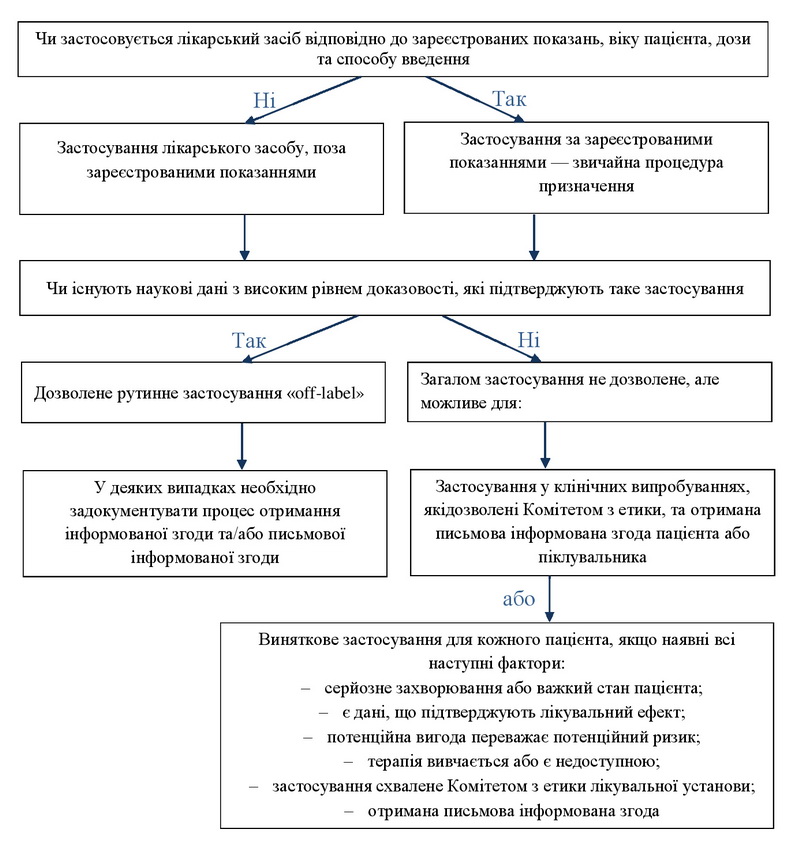
За даними FDA, належна медична практика та забезпечення найвищої вигоди для пацієнта потребують застосування дозволених лікарських і біологічних засобів та медичного обладнання відповідно до всіх доступних даних та рішення, що винесене з урахуванням усіх відомих фактів та обставин. Якщо лікарі призначають засоби відповідно до показань, які не мають офіційного затвердження, вони несуть відповідальність за те, що добре обізнані про засіб і основи його раціонального застосування, надані виробником і обґрунтовані переконливими доказами [33].
Австралійський комітет охорони здоров’я та раціонального використання ліків ще у 2006 р. розробив підхід щодо доцільного використання лікарських засобів «off-label» [34]:
Деякі автори пострадянського простору рекомендують лікарям, які вважають, що інтереси пацієнта потребують призначення лікарських засобів «off-label», надати письмове аргументоване обґрунтування цього призначення в історії хвороби, де має бути відображено, що призначення необхідне, а дозволеної альтернативи немає. Потрібен також висновок консиліуму за участі профільних фахівців і клінічного фармаколога або медичної комісії за участі представника адміністрації лікарні [35].
Мета призначення лікарських засобів «off-label» спрямована на користь для пацієнта. Слід розуміти, що «off-label» не завжди означає, що воно є нелегальним, неправильним, протипоказаним або застосоване з метою вивчення [30]
Проте законодавство України не містить правових норм щодо застосування ліків поза зареєстрованими показаннями. Існує єдиний закон, який стосується використання усіх товарів, зокрема медичного призначення (препаратів, пристроїв, обладнання тощо). Стаття 4, п. 3 Закону України «Про захист прав споживачів» зобов’язує використовувати товар (у т.ч. медичні препарати) відповідно до його цільового призначення та дотримувати умов (вимог, норм, правил), викладених виробником в експлуатаційній документації. Це означає, що лікарі, які призначають терапію «off-label», порушують законодавство, а деякі групи пацієнтів (наприклад з орфанними захворюваннями) залишаються незахищеними.
З іншого боку, в іншомовних виданнях наголошується, що призначення ліків є прерогативою та відповідальністю лікаря. У журналі «Duke Law Journal» у 2014 р вийшла велика публікація, присвячена питанню регулювання застосування лікарських засобів та виробів медичного призначення «off-label» у США. Автори наголошують, що FDA не забороняє застосування лікарські засоби поза зареєстрованими показаннями до того моменту, коли будуть проведені специфічні дослідження з приводу такого застосування. Але регулювати ці призначення потрібно. Публікація пропонує виробникам проводити окрему ретельну реєстрацію побічних явищ при застосуванні препаратів «off-label», змінити маркування ліків із застосуванням так званих спеціальних виділених місць з вказівками щодо випадків абсолютно забороненого застосування препаратів поза зареєстрованими показаннями [36].
Читайте також: Перепрофилирование лекарственных средств — модный тренд?
Управління з контролю за харчовими продуктами та лікарськими засобами США (FDA) та Європейська медична агенція (EMA) забороняють виробникам рекламувати ліки для застосування «off-label». Європейська федерація фармацевтичної індустрії та асоціацій (EFPIA) у своєму меморандумі [37] наголошує, що лікарські засоби, які зареєстровані за специфічними показаннями, завдяки всебічному тривалому тестуванню мають високий ступінь співвідношення користь/ризик для специфічних показань. Разом з тим національні структури охорони здоров’я (у т.ч. відділи визначення ціна–ефективність, страхової медицини тощо) деяких європейських країн затвердили або розглядають затвердження регуляторних змін, які підтримують застосування лікарських засобів поза зареєстрованими показаннями.
Так, у Франції у 2012 р. були внесені зміни до законодавства, в яких уряд уповноважується розглянути можливість застосування лікарських засобів «off-label» виключно для економічної вигоди. Італія у 2014 р. прийняла закон про підтримку застосування медикаментів «off-label», яке, незважаючи на наявність ліцензованого методу лікування, відповідає економічній вигоді [38]. У Німеччині деякі фонди укладають угоду з асоціаціями лікарів, яка забезпечує фінансове заохочення застосування препаратів «off-label» [39]. Національний інститут клінічної якості (NICE) також включає у свої рекомендації застосування лікарських засобів «off-label» (наприклад, сертралін, авастин, алерган та інші) [40].
В українських протоколах та адаптованих клінічних настановах теж мають місце рекомендації щодо застосування препаратів «off-label» [41, 42].
Все це зумовлює необхідність ретельного вивчання та обґрунтування питань застосування лікарських засобів та медичних виробів поза зареєстрованими показаннями на сторінках професійних видань. Конче необхідно на офіційному рівні регулювання не тільки призначення «off-label», але і реклами такого застосування у вигляді брошур, листівок, наукових публікацій, презентацій, в яких подається інформація про незареєстроване застосування лікарських засобів та медичних виробів.
Михайло Арістов, канд. мед. наук
Література
- Brosgart C, Mitchell T, Charlebois E, et al. Off-label drug use in human immunodeficiency virus disease. J Acquir Immune Defic Syndr Hum Retrovirol 1996; 12: 56–62.
- Douglas-Hall P, Fuller A, Gill-Banham S. An analysis of off-licence prescribing in psychiatric medicine. Pharm J 2001; 267: 890–891.
- Cuzzolin L, Zaccaron A, Fanos V. Unlicensed and off-label uses of drugs in paediatrics: a review of the literature. Fundam Clin Pharmacol 2003; 17: 125–131.
- Radley D. C., Finkelstein S. N., Stafford R. S.. Off-label prescribing among office-based physicians Arch Intern Med. 2006;166:1021–1026.
- Eguale T., Buckeridge D. L., Verma A. Association of off-label drug use and adverse drug events in an adult population. JAMA Intern Med.2016;176(1):55–63.
- Tewodros Eguale et al., “Drug, patient and physician characteristics associated with off-label prescribing in primary care,” Archives of Internal Medicine, vol. 172, no. 10, May 28, 2012, pp. 781–788.
- Demonaco H.J., Ali A., Ev H. The major role of clinicians in the discovery of off-label drug therapies. Pharmacotherapy (2006) 26(3):323–332.
- Eguale T, Buckeridge DL, Winslade NE, Benedetti A, Hanley JA, Tamblyn R. Drug, patient, and physician characteristics associated with off-label prescribing in primary care. Arch Intern Med (2012) 172(10):781–788.
- Hamel S., McNair D. S., Birkett N. J. et al. Off-label use of cancer therapies in women diagnosed with breast cancer in the United States. SpringerPlus (2015) 4:209.
- Dean-Colomb W., Fang S., Smith W., Michaud L., Hortabagyi G.N., Giordano S. Off-label drug use in women with breast cancer. J Clin Oncol 2009. 27:15, suppl; abstr 1016.
- Hershman D.L., Neugut A.I., Buono D. et al. Off-label and compendia use of chemotherapy in patients with metastatic cancer. 2013 ASCO Annual Meeting. Abstract 6509. Presented August 9, 2013.
- Krzyzanowska M.K. Off-Label Use of Cancer Drugs: A Benchmark Is Established. J Clin Oncol.2013 Mar 20;31(9):1125–7.
- Conti RM, Bernstein AC, Villaflor VM, et al: Prevalence of off-label use and spending in 2010 among patent-protected chemotherapies in a population-based cohort of medical oncologists. J Clin Oncol 31:1134–1139, 2013.
- Prescription pharmaseuticals in Canada. Off-label use. The Standing Senate committee on Social Affairs, Science and Technology Senate, Ottawa, Ontario, Canada. Extract from the Journals of the Senate, Tuesday, November 19, 2013
- Tewodros Eguale et al., “Drug, patient, and physician characteristics associated with off-label prescribing in primary care,” Archives of Internal Medicine, vol. 172, no. 10, May 28, 2012, pp. 781–788.
- Dunne J. The European Regulation on medicines for paediatric use. Paediatric Respiratory Reviews, vol. 8, no. 2, pp. 177–183, 2007.
- Kimland E., Odlind V. Off-label drug use in pediatric patients.Clinical Pharmacology & Therapeutics, vol. 91, no. 5, pp. 796–801, 2012.
- Cuzzolin L., Atzei A., Fanos V. Off-label and unlicensed prescribing for newborns and children in different settings: a review of the literature and a consideration about drug safety.Expert Opinion on Drug Safety. 5, no. 5, pp. 703–718, 2006.
- Conroy, S., Choonara, et al. Survey of unlicensed and off label drug use in paediatric wards in European countries. European Network for Drug Investigation in Children. BMJ 2000.320: 79–82.
- McIntyre, J., Conroy, S., Avery, A., Corns, H. and Choonara, I.. Unlicensed and off label prescribing of drugs in general practice. Arch. Dis. Child. 2000.83: 498–501.
- Chalumeau, M., Treluyer, J. M. and Salanave, B. et al. Off label and unlicensed drug use among French office based pediatricians. Arch. Dis. Child. 2000.83: 502–505.
- T Jong, G. W., Eland, I. A., Sturkenboom, M. C., van den Anker, J. N., Stricker, B. H. Unlicensed and off label prescription of drugs to children: population based cohort study. BMJ 2002. 324: 1313–1314.
- O’Donnell, C. P., Stone, R. J.,Morley, C. J. Unlicensed and off-label drug use in an Australian neonatal intensive care unit. Pediatrics 2002. 110: e52.
- Barr J., Brenner-Zada G., Heiman E. et al. Unlicensed and off-label medication use in a neonatal intensive care unit: a prospective Am. J. Perinatol. 2002. 19(2), 67–72.
- Mohd Masnoon Saiyed, Tarachand Lalwani, Devang Rana.Off-label medicine use in pediatric inpatients: a prospective observational study at a tertiary care hospital in India. International Journal of Pediatrics. V 2014, Article ID 415815.
- Lat I., Micek S., Janzen J., Cohen H., Olsen K., Haas C. Off-label medication use in adult critical care patients. 2011 Crit Care. Feb;26(1): 89–94.
- Baletta J.F., Lat I., Micek S.T., Cohen H., Olsen K.M. Off-label use of gastrointestinal medications in the intensive care unit. J. Intencive Care Med. 2015 May;30(4): 217–25.
- American academy of pediatrics. Policy statement. Off-Label Use of Drugs in Children. P Vol 133, N. 3, Mar. 2014.
- Schork N. Personalized medicine: time for one-person trials. Nature. 2015;520:609–611.
- Neville K.A., Frattarelli D.A., Galinkin J.L. et al. Off-label use of drugs in children. Pediatrics. 2014;133:563–567.
- Henry V. Off-label prescribing. Legal implications. J Leg Med. 1999;20:365–383.
- Ansani N., Branch R., Fedutes-Henderson B., et al. United States medical practice summary: innovative off-label medication use. Am J Med Qual. 2006;21:246–254.
- US Food and Drug Administration. “Off-label” and investigational use of marketed drugs, biologics, and medical devices—Information sheet. https://www.fda. gov/RegulatoryInformation/Guidances/ucm126486.htm. Updated June 25, 2015. Accessed June 27, 2015.
- Gazarian M., Kelly M., McPhee J. R., Graudins L. V., Ward R. L., Campbell T. J. Off-label use of medicines: consensus recommendations for evaluating appropriateness. MJA. Vol. 185, N 10:544–548.
- А.Н. Грацианская, А.А. Бологов, М.Н. Костылева, С.С Постников. Проблема «off-label» назначений в педиатрическом стационаре: опыт РДКБ Детская больница № 4.
- Abbot R. Ayers I. Evidence and extrapolation: mechanism for regulating off-label use of drugs and devices. Duke law journal, Dec. 2014, Nov.3. v 64:377–
- Promotion of off-label use of medicines by European healthcare bodies in indications where authorised medicines are available. Position paper. EFPIA. May 2014.
- Articles 86 and 87 of Directive 2001/83.
- Frankfurter Allgemeine Zeitung, 24 February 2011, page N1.
- Guideline CG 11, Guideline AT 229.
- Адаптована клінічна настанова, заснована на доказах. ВІЛ інфекція у дітей. Рекомендовано наказ МОЗ України 02.2015 № 92.
- Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги. Рак легені. Затверджено наказ МОЗ України 04 червня 2014 року № 387.