Ученые добавили в генетический алфавит новые «буквы» и научили бактерии их «читать»
Теперь ДНК, содержащая искусственную третью пару нуклеотидных оснований, не только успешно реплицируется, но и транслируется в белок. Дополнительные «буквы» в генетическом алфавите – это возможность кодирования значительно больших объемов информации, включения в белки неканонических аминокислот, создания макромолекул с любыми заданными функциями
Как известно, генетическая информация всех живых существ на Земле закодирована с помощью четырех нуклеотидов. При синтезе белка каждые три нуклеотида-«буквы» кода соответствуют одной из 20 аминокислот. Ученые из Исследовательского института Скриппса в Калифорнии ранее создали полусинтетические бактерии Escherichia coli, способные стабильно воспроизводить ДНК, содержащую кроме природных пар нуклеотидов аденин-тимин (A-T) и гуанин-цитозин (G-C), дополнительную пару X-Y. В качестве X выступил синтетический дезоксинуклеозид dNaM, Y — dTPT3.
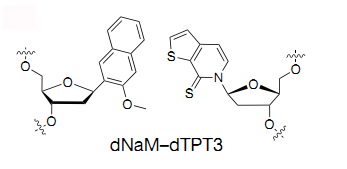
В искусственной паре оснований dNaM-dTPT3 (dX-dY) комплементарность обеспечивается за счет гидрофобных взаимодействий, а не за счет водородных связей, как в канонической паре dA-dT.
Бактерии не способны синтезировать Х и Y самостоятельно, поэтому их в виде трифосфатов добавляли в питательную среду. Чтобы вещества попали в клетку, бактерию снабдили геном специального белка-транспортера из водоросли Phaeodactylum tricornutum. Дополнительные «буквы» в генетическом алфавите – это возможность кодирования значительно больших объемов информации, включения в белки неканонических аминокислот, создания макромолекул с любыми заданными функциями. Но для этого нужно научить белок-синтезирующий аппарат бактерий «читать» новые нуклеотидные «буквы».
Чтобы полусинтетическая ДНК могла реплицироваться и передаваться из поколения в поколение, необычные основания должна узнавать ДНК-полимераза. Однако, чтобы при помощи полусинтетической ДНК можно было синтезировать белок, необходимо адаптировать к ней весь аппарат трансляции генетической информации. В новой работе ученым удалось это сделать.
Чтобы синтезировать белок, закодированный в каком-либо гене, сначала необходимо скопировать информацию с ДНК на молекулу матричной РНК (мРНК). Три нуклеотида мРНК (кодон) соответствуют одной аминокислоте в составе белка. Соответствие кодона и аминокислоты обеспечивает транспортная РНК (тРНК), которая содержит в себе антикодон, комплементарный кодону в мРНК. Аминоксилоту к своей тРНК присоединяет фермент аминоацил-тРНК-синтетаза (для каждой из 20 канонических аминокислот есть свой такой фермент – аланил-тРНК-синтетаза, серил-тРНК-синтетаза и т.д.). Расшифровка генетической информации происходит на рибосомах, которые последовательно узнают кодоны мРНК, сопоставляют им соответствующие антикодоны тРНК, несущих аминокислоты, и присоединяют эти аминокислоты к растущей белковой цепи. Так генетическая информация транслируется в структуру белка.
Способность полусинтетической ДНК кодировать информацию проверяли с помощью гена зеленого флуоресцентного белка (GFP), в который ввели искусственное нуклеотидное основание Х. Тирозин (TAC) в позиции 151 заменили на серин, но вместо кодона AGC в ген встроили кодон AXC. Чтобы обеспечить соответствие кодон-антикодон, в ген тРНК серина ввели последовательность GYT.
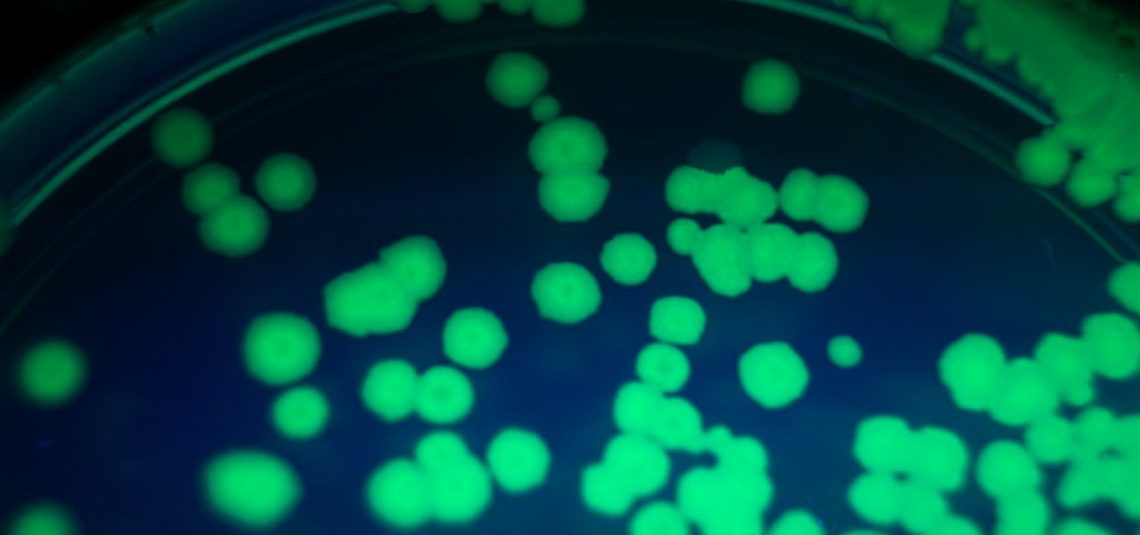
Чтобы в клетке могла синтезироваться полусинтетическая РНК, в питательную среду бактерий пришлось добавить рибонуклеозидфосфаты NaM и TPT3. белок-транспортер из водоросли успешно закачивал их в клетку, а вирусная РНК-полимераза эффективно встраивала новые «буквы» в РНК. Сериновая аминоацил-тРНК-синтетаза успешно присоединила серин к модифицированной тРНК, и аминокислота встроилась в белок – об этом просигнализировало зеленое свечение клеток. Если мутантного гена для тРНК не было, свечения также отсутствовало, так как синтез белка останавливался на 151-й позиции.
Следующим экспериментом стало присвоение искусственному кодону AXC неканонической аминокислоты пирролизина (природная аминокислота, включающаяся в белки некоторых метаногенных архей). Для этого в кишечную палочку дополнительно ввели гены тРНК и соответствующей аминоацил-тРНК-синтетазы для пирролизина из архей Methanosarcina barkeri. Включение пирролизина в белок также определяли по свечению бактерий, которое достигло почти 70 процентов от свечения клеток с «натуральным» белком. Включение аминокислоты также детектировали по специфическому присоединению к остатку пирролизина флуоресцентного красителя в составе очищенного белка.
Помимо кодона AXC исследователи протестировали кодон GXC и соответствующий ему антикодон GYC, которые также успешно сработали для пирролизина.
На сегодня у полученных штаммов бактерий нет никаких практических задач. Однако, расширение генетического кода и возможностей синтеза белка в клетке открывает перспективы, масштаб которых еще трудно оценить: потенциально любая идея химиков, биологов, фармакологов становится реализуемой в метаболизме живого организма.
На фото под заголовком: экспрессия зеленого флуоресцентного белка (GFP) в E. coli; Bishonen/Flickr