Ученым удалось омолодить мышей, удалив состарившиеся клетки
Ученые прицельно удалили* состарившиеся клетки в организме, «сломав» систему, которая мешает их естественной гибели (апоптозу)
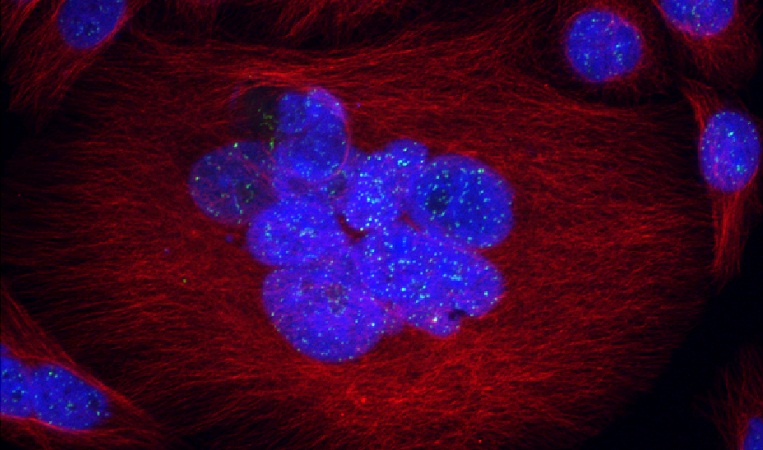
Все клетки в организме (кроме раковых) имеют лимит деления. Чем старше организм, из которого берут клетку для культивирования, тем меньшее число раз она удвоится. Кроме того, с каждым делением в клетках накапливается все больше повреждений ДНК. Состарившись, клетка перестает делиться вовсе – становится сенесцентной. Сенесцентные клетки имеют специфическую морфологию — они крупные, уплощенные, с большими ядрами, сильно вакуолизированы, у них меняется профиль экспрессии генов. Клетка может находиться в таком состоянии длительное время, не подвергаясь запрограммированной гибели – апоптозу. С одной стороны, сенесценция защищает от развития рака, с другой, когда с возрастом сенесцентные клетки накапливаются в тканях, приводит к развитию дегенеративных процессов и, соответственно, возрастных заболеваний. Важными факторами таких заболеваний являются оксидативный стресс и воспаление, которое связано с экспрессией провоспалительных цитокинов старыми клетками.
Читайте также: Пять мифов о старости
Можно ли очистить организм от состарившихся клеток и таким образом уберечь от возрастных заболеваний? В поисках ответа на это вопрос ученые из Университета Эразма, Медицинского университета Граца и Баковского исследовательского института старения занялись исследованием клеточных механизмов, предохраняющих сенесцентные клетки от апоптоза. Они проанализировали, какие гены активны в нормальных и искусственно состаренных радиацией человеческих фибробластах. Оказалось, что в состарившихся клетках гены, отвечающие за апоптоз, активированы, однако их действие заблокировано белком – фактором транскрипции FOXO4. При подавлении синтеза этого белка, жизнеспособность клетки резко снижалась.
Читайте также: Дефицит движения ускоряет старение
Оказалось, что белок FOXO4 накапливается в области поврежденных участков ДНК рядом с противоопухолевым белком р53, регулирующим апоптоз, и может взаимодействовать с этим белком, препятствуя гибели состарившейся клетки.
Ученые синтезировали FOXO4 с модифицированным участком связывания с р53. Полученный белок FOXO4-DRI препятствовал взаимодействию FOXO4 с р53 in vitro. Для облегчения проникновения FOXO4-DRI в клетку, ученые повысили его липофильность и убедились, что FOXO4-DRI стимулирует апоптоз.
Далее FOXO4-DRI испытали на мышах, состаренных тремя способами: естественным образом, химиотерапевтическим препаратом доксорубицином, генетической модификацией. Белок FOXO4-DRI селективно действовал на сенесцентные клетки, вызывая их апоптоз. Удаление состарившихся клеток из организма животного привело к восстановлению функций печени, нарушенных доксорубицином, а также восстановлению некоторые утраченных или ослабленных в результате старения функций (усиливало выносливость, улучшало функции почек, прекращало облысение у животных со всеми типами старения). Побочных эффектов при этом не наблюдалось.
Еще предстоит выяснить, будет ли терапия FOXO4-DRI эффективной и безопасной у людей, однако перспектива лечения, которое может восстанавливать тканевой гомеостаз, когда возрастное ухудшение здоровья уже наступило, представляется очень заманчивой.
Читайте также: Лекарство для лечения сахарного диабета замедляет старение?
* Marjolein P. Baar, Renata M.C. Brandt, Diana A. Putavet, Julian D.D. Klein, et al. (2017) Targeted Apoptosis of Senescent Cells Restores Tissue Homeostasis in Response to Chemotoxicity and Aging // Cell, 2017, Volume 169, Issue 1, p132–147.e16, 23 March 2017. DOI: https://dx.doi.org/10.1016/j.cell.2017.02.031
На фото: сенесцентная клетка с множественными ядрами (синий цвет) и аберрантным числом центросом (красный цвет); конфокальная микроскопия.