Удивительные возможности аптамеров
В последние годы в медицине активно изучают возможности использования нуклеиновых кислот в качестве терапевтических и диагностических препаратов. Это связано с открытием свойства олигонуклеотидов, получивших название «аптамеры», специфически связываться с разнообразными молекулами-мишенями. В чем же преимущества такого подхода?
«Узнавать» другие молекулы!
Аптамерами называют одноцепочечные молекулы ДНК или РНК, которые могут образовывать сложную трехмерную пространственную структуру, комплементарную другим поверхностям, и поэтому способную «узнавать» другие молекулы или даже проявлять каталитическую активность.
Как известно, под комплементарностью в химии, молекулярной биологии и генетике подразумевают взаимное соответствие молекул биополимеров либо их фрагментов, обеспечивающее образование связей между пространственно взаимодополняющими (комплементарными) фрагментами, молекул или их структурных фрагментов вследствие супрамолекулярных взаимодействий (образование водородных связей, гидрофобных, электростатических взаимодействий заряженных функциональных групп и т.п.).
Однако следует отметить, что такие пространственные структуры могут быть образованы только одноцепочными ДНК или РНК, поскольку их двухцепочные формы имеют структуру двойной спирали независимо от последовательности.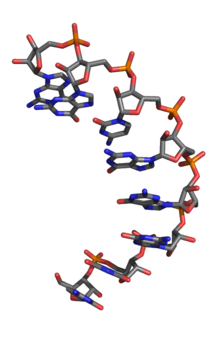
Аптамеры получили свое название от латинского слова aptus — подходящий. Они представляют собой небольшие (обычно от 20 до 60 нуклеотидов) одноцепочечные молекулы РНК или ДНК, способные с высокой аффинностью и специфичностью связываться с молекулой-мишенью. К настоящему времени аптамеры могут быть получены практически к любым мишеням: белкам, полисахаридам, малым органическим молекулам, вирусам и целым клеткам.
Весьма оригинальная методика
Как же получают аптамеры? Суть процедуры получения аптамеров, названной SELEX (аббревиатура от англ. Systematic Evolution of Ligands by Exponential Enrichment — системная эволюция лигандов экспоненциальным обогащением), заключается в следующем. Например, в пробирке искусственно синтезируют короткие однонитевые РНК, состоящие из трех частей: по краям последовательности нуклеотидов у всех молекул РНК одинаковые, а вот центральная часть (длиной около 20–30 нуклеотидов) у всех РНК вариабельная. Как показывает расчет, из двух десятков этих нуклеотидов можно создать «астрономическое» число отличающихся друг от друга нуклеотидных последовательностей (примерно 17-значное число вариантов!). Выяснилось, что в таком гигантском наборе разнообразных коротких РНК (его называют комбинаторной библиотекой) практически всегда найдется один или даже несколько вариантов молекул, которые способны специфически связываться, например, с белком-мишенью и подавлять его биологическую активность.
Аптамеры могут найти применение в качестве средств целевой доставки радиоизотопов, цитотоксичных агентов и других традиционных лекарственных средств
Олигонуклеотиды, не связавшиеся с мишенью, удаляют, а связавшиеся амплифицируют с помощью полимеразной цепной реакции. Данный цикл многократно повторяют, в результате чего происходит обогащение последовательностями, имеющими сродство к молекуле-мишени. После этого молекулы аптамеров клонируют в составе плазмид и индивидуально проверяют их свойства.
После отбора молекул РНК (реже ДНК), которые специфически связываются, например, с определенным белком, проводят еще одну селекцию: отбирают те аптамеры, которые не только соединяются с белком, но и подавляют его активность. В случае успеха исследователи получают мощный специфический агент (читай — лекарственный препарат), направленный на единственную мишень. После привнесения в клетку такой аптамер окажет влияние исключительно на тот единственный белок-мишень, для которого он был предварительно отобран, и при этом не вызовет каких-либо побочных эффектов.
Перспективным направлением биофармацевтики может стать создание аптамеров к инфицированным живым клеткам для выявления их в организме и целевой доставки к ним токсинов
Кроме того, после окончания действия такое лекарство полностью биодеградируется, поскольку ДНК не является для клетки ксенобиотиком, то есть никакого накопления побочных продуктов не происходит.
Следовательно, аптамеры в принципе являются потенциально весьма перспективным классом соединений для создания новых лекарств.
Читайте также: Есть ли смысл в разработке антисенсов?
«Мастера на все руки»
В число мишеней аптамеров входят антибиотики, дисахариды, аминогликозиды, органические красители, нейротрансмиттеры, порфирин и биотин. Подавляющее число белков, являющихся мишенями для аптамеров, представляют собой лиганды для полианионов (нуклеиновых кислот или гликозаминогликанов), например, тромбин или иные белки-компоненты свертывающей  системы крови, некоторые гепаринсвязывающие факторы роста, транскрипционные факторы, вирусные регуляторные белки. Высказывают предположение, что некоторые гепаринсвязывающие белки (например, тромбин) могут иметь естественные аптамеры в плазме крови.
системы крови, некоторые гепаринсвязывающие факторы роста, транскрипционные факторы, вирусные регуляторные белки. Высказывают предположение, что некоторые гепаринсвязывающие белки (например, тромбин) могут иметь естественные аптамеры в плазме крови.
Идея создания аптамеров, распознающих специфические макромолекулы возбудителей (например, белковые факторы вирулентности или токсины), является весьма привлекательной, но пока еще не реализованной окончательно. Однако именно этот подход открывает новое направление в создании лекарственных средств с антимикробной и антивирусной активностью и формирует принципиально новый класс препаратов — аптамеров [1]. Таким образом, имеются все предпосылки для использования аптамеров в качестве детекторов неиммуногенных мишеней или токсичных белков.
Аптамеры могут быть использованы в решении различных исследовательских, диагностических и терапевтических задач. Их можно рассматривать как аналоги моноклональных антител и при этом они имеют ряд важных преимуществ перед антителами. Получить аптамеры намного проще, дешевле и быстрее, чем моноклональные антитела. Они имеют значительно меньший размер и поэтому легче проникают в ткани и клетки, а также могут иметь более высокую аффинность и специфичность.
Читайте также: Революция в редактировании генома (часть 1)
Революция в редактировании генома (часть 2)
Большие перспективы имеют аптамеры в качестве препаратов для лечения аутоиммунных заболеваний, с которыми до настоящего времени борются с помощью методов неспецифического подавления иммунной системы. Значительный прогресс в лечении этой патологии связывают со специфическим ингибированием антител, однако ингибирующие пептиды сами могут вызывать иммунный ответ. Поэтому хорошей альтернативой ингибирующим пептидам могут стать аптамеры, поскольку они обладают ничтожно малой иммуногенностью [2].
Аптамеры можно рассматривать как аналоги моноклональных антител и при этом они имеют ряд важных преимуществ перед антителами. Получить аптамеры намного проще, дешевле и быстрее, о ни имеют значительно меньший размер и поэтому легче проникают в ткани и клетки, могут иметь более высокую аффинность и специфичность
Аптамеры могут найти применение в качестве средств целевой доставки радиоизотопов, цитотоксичных агентов и других традиционных лекарственных средств, что уже было доказано в ряде экспериментов [3]. В частности, аптамеры к онкомаркерам рака молочной железы, легкого, прямой кишки, глиобластомы связывали с различного рода лекарственными средствами и использовали их для целевой доставки к мишени [3]. Перспективным и многообещающим направлением биофармацевтики может стать создание аптамеров к инфицированным живым клеткам для выявления их в организме и целевой доставки к ним токсинов [4].
Основным препятствием к широкому распространению аптамеров в медицинской практике на сегодня является отсутствие их стандартизации в разрабатываемых протоколах
Это лишь некоторые из огромного количества примеров удивительных возможностей применения аптамеров в медицине.
«Наноинженерный» подход
В силу физико-химических свойств нуклеиновых кислот и потенциала современного химического синтеза олигонуклеотидов аптамерные последовательности могут быть модифицированы для получения молекулярных конструкций с новыми свойствами для различных целей, что является предпосылкой к появлению «наноинженерного» подхода к созданию аффинных реагентов.
Так, например, уже известны модификации, созданные для придания устойчивости к действию нуклеаз; для включения функциональных групп (5-йод-, 5-бром-, 4-тиоуридин-), активирующихся при облучении [5]; для внесения в состав аптамера флуоресцентных групп [6]; для ассоциации аптамера с лекарственным препаратом [7] и др.
Исследования продолжаются
Основным препятствием к широкому распространению аптамеров в медицинской практике на сегодня является отсутствие их стандартизации в разрабатываемых протоколах. Так, полученные в разных лабораториях аптамеры к одной и той же молекуле-мишени помимо различий в первичной структуре почти наверняка будут различаться и по таким параметрам, как аффинность, специфичность и другие кинетические характеристики. Однако исследования продолжаются и, по-видимому, это, а также некоторые другие препятствия вскоре будут устранены.
Читайте также: В США вперше схвалили препарат для РНК-терапії
В настоящее время разработка средств для диагностики и терапии на основе аптамеров становится одним из наиболее перспективных направлений медицинской биотехнологии. В этой связи уместно вспомнить великого Эрлиха, ведь препараты на основе аптамеров будут весьма походить на ту «волшебную пулю», которая, как мечтал ученый, «сама найдет и убьет возбудителя болезни, не нанося ущерба пациенту».
Подготовил Руслан Примак,
канд. хим. наук
Литература
- Keefe A.D., Pai S., Ellington A. Aptamers as therapeutics // Nature Reviews Drug Discovery. – 2010. – Vol. 9. – Р. 537-550.
- Hwang B., Han K., Lee S.W. Prevention of passively transferred experimental autoimmune myasthenia gravis by an in vitro selected RNA aptamer // FEBS Lett. – 2003. – Vol. 548. – P. 85-89.
- Partha R., Rebekah R. Aptamers for Targeted Drug Delivery White // Pharmaceuticals. – 2010. – Vol. 3. – Р. 1761-1778.
- Jeon S.H., Kayhan B., Ben-Yedidia T. et al. DNA aptamer prevents infl uenza infection by blocking the receptor binding region of the viral haemagglutinin // J. Biol. Chem. – 2004. – Vol. 279. – P. 48410-48419.
- Golden M.C., Collins B.D., Willis M.C. et al. Potential of Photo SELEX-Evolved ssDNAAptamers // J. Biotechnol. – 2000. – Vol. 81. – P. 167-178.
- Pestourie C., Tavitian B., Duconge F. Aptamers against extracellular targets for in vivo application // Biochemie. – 2005. – Vol. 87. – P. 921-930.
- Farokhzad O.C., Jon S., Khademhosseini A. et al. Nanoparticle-aptamerbioconjugates: a new approach for targeting prostate cancer cells // Cancer Res. – 2004. – Vol. 64. – P. 7668-7672.
“Фармацевт Практик” #9′ 2018